1、选择题 下列比较中正确的是
A.金属性:Mg>Al>Na
B.原子半径:S>O>F
C.碱性:KOH>Mg(OH)2>NaOH
D.氢化物稳定性:HBr>HCl>PH3
参考答案:B
本题解析:考查元素周期律的应用。同主族元素自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱。同周期元素自左向右原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。所以金属性是Na>Mg>Al,碱性是KOH>NaOH>Mg(OH)2,氢化物稳定性是HCl>HBr> PH3。所以正确的答案是B。
本题难度:困难
2、填空题 (1)某元素最高化合价为+5,原子最外层电子数为2,半径是同族中最小的,其核外电子排布式为
_________,价电子构型为_________,属_________区元素。
(2)某元素原子的价电子构型为4s24p1,它属于第_________周期,_________族,最高正化合价为_________,元素符号是_________。
(3)原子序数为24的元素原子中有_________个电子层,_________个能级,_________个未成对电子。
(4)请写出有2个能层的p轨道中只有一个未成对电子的基态原子的外围电子排布图(有几个写几个)
__________________
参考答案:“略”
本题解析:
本题难度:一般
3、选择题 能够说明硫的非金属性比氯弱的事实有( )
①Cl2与铁反应生成FeCl3,S与铁反应生成FeS?
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度?
③将Cl2通入氢硫酸中可置换出硫?
④常温时硫单质为固态而氯单质为气态.
A.①③
B.①②③
C.②④
D.①②③④
参考答案:①Cl2与铁反应生成FeCl3,S与铁反应生成FeS,则Cl得电子的能力强,所以硫的非金属性比氯弱,故①正确;
②Cl2和H2的混合气,经强光照射可剧烈反应,而S与H2反应需较高温度,则Cl与氢气易化合,所以硫的非金属性比氯弱,故②正确?
③将Cl2通入氢硫酸中可置换出硫,由氧化还原反应可知,硫的非金属性比氯弱,故③正确;?
④常温时硫单质为固态而氯单质为气态,物质的状态不能说明元素的非金属性强弱,故④错误;
故选B.
本题解析:
本题难度:简单
4、推断题 短周期元索A、B、C、D,其有关性质或结构信息如表所示。
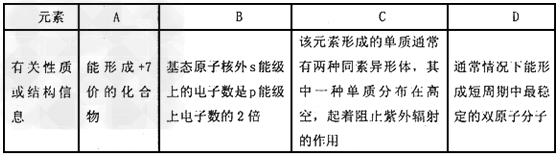
(1)?B位于元素周期表中第________周期第_______族,元素B和元素C相比,电负性较小的是_______?(写元索名称)。化合物BC2晶体与B的单质晶体属_______?(填同一类型或不同类型)。
(2)?写出元素C的含有10个中子的一种核素符号_______B的一种氢化物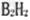 分子中σ键与π键的数目之比为_______。?
分子中σ键与π键的数目之比为_______。?
(3)?C与D可以组成多种形式的化合物.其中D2C5能勾水反应生成物质X。写出物质X的稀溶液与过景的Fe反应的离子方程式:____________________________。
(4)?A的最髙价氧化物为无色液体,9.?15g该物质与足跫的水混合,得到一种稀溶液,并放出QKJ热量,该反应的热化学反应方程式为______________。
参考答案:(1)二;ⅣA?;碳;不同类型
(2) ;3:2
;3:2
(3)3Fe?+?8H+?+?2NO3-==3Fe2+?+?2NO↑?+?4H2O
(4)Cl2O7(l)+H2O(l)==2HClO4(aq)?△H=-20QkJ/mol
本题解析:
本题难度:一般
5、选择题 镭是元素周期表中第七周期第ⅡA族元素,下列关于镭的性质描述不正确的是( )
A.在化合物中呈+2价
B.单质能和水反应,放出氢气
C.镭比钙的金属性弱
D.碳酸镭难溶于水
参考答案:A.镭最外层有2个电子,在化合物中呈+2价,故A正确;
B.同主族元素从上到下金属性逐渐增强,镭的金属性较强,单质性质活泼,与水反应放出氢气,故B正确;
C.同主族元素从上到下金属性逐渐增强,镭的金属性较强,镭比钙的金属性强,故C错误;
D.同主族元素性质相似,碳酸钙不溶于水,则碳酸镭难溶于水,故D正确.
故选C.
本题解析:
本题难度:简单