1、计算题 (8分)28gFe与足量稀盐酸混合,充分反应,消耗多少克HCl?生成FeCl2的物质的量为多少?标准状况下最多能收集到多少升气体?
参考答案:消耗36.5gHCl;生成FeCl2的物质的量为0.5mol;标准状况下最多能收集到11.2L气体。
本题解析:解:Fe + 2HCl = FeCl2 + H2↑
56g 2x36.5g 1mol 22.4L
28g m(HCl) n(FeCl2) V(H2)
m(HCl)=(28x2x36.5)/56=36.5g n(FeCl2)=28x1/56=0.5mol V(H2)=28x22.4/56=11.2L
考点:考查化学反应的计算.
本题难度:一般
2、选择题 体积为V mL,密度为d g/ml,溶质的摩尔质量为M g·mol-1,物质的量浓度为c mol·L-1,溶质的质量分数为a%,溶质的质量为m g。下列式子正确的是
A.m = aV/100d
B. c = 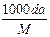
C.c = 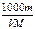
D. a% =  %
%
参考答案:C
本题解析:略
本题难度:简单
3、计算题 (8分)32g铜与150mL一定浓度的硝酸恰好完全反应,产生的NO2和NO混合气体在标准状况下的体积为11.2L.请回答:(不要求写计算过程)
(1)写出铜与稀硝酸反应的化学方程式
(2)NO为 mol.标准状况V(NO):V(NO2)=
(3)原硝酸溶液的浓度为 mol?L-1
(4)试描述实验过程中试管内产生气体现象
参考答案:(1)3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)0.25,1:1; (3)10; (4)气体颜色逐渐变浅.
本题解析:(1)写出铜与稀硝酸反应的化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O
(2)设NO2的物质的量为x,NO的物质的量为y,则有
x+y=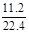
x+3y=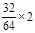
解得:x=0.25mol y=0.25mol
则V(NO):V(NO2)=1:1
(3)铜与硝酸恰好反应,根据N原子守恒,n(HNO3)=n(NO3-)+n(气体),又知n(Cu2+)=0.5mol,所以n(NO3-)=1mol,则n(HNO3)=1.5mol,c(HNO3)=" 10" mol?L-1。
(4)随着硝酸变稀,产生的NO2变少,NO变多,所以实验过程中试管内产生气体的现象是气体颜色逐渐变浅。
考点:计算题
点评:原子守恒解本题比较简单。
本题难度:困难
4、选择题 配制一定物质的量浓度的NaOH溶液时,可造成所配溶液浓度偏高的是( )
A.所用NaOH已吸潮
B.向容量瓶滴加水时液面低于刻度线即摇匀
C.有少量NaOH溶液残留在烧杯内
D.向容量瓶加水时仰视液面
参考答案:B
本题解析:
本题难度:简单
5、选择题 设NA为阿伏加德罗常数的值,下列说法一定正确的是
A.38.5gCCl4中含有的共用电子对数为NA
B.1mol铵根离子中含有的电子数为9NA
C.pH=13的NaOH溶液中含有的Na+数为0.1 NA
D.11.2LCl2通 入足量的NaOH溶液中,转移的电子数为0.5NA
入足量的NaOH溶液中,转移的电子数为0.5NA
参考答案:A
本题解析:略
本题难度:一般