1、选择题 金属钠长期露置在空气中,最后转变为(?)
A.Na2CO3
B.Na2O2
C.NaOH
D.Na2O
参考答案:A
本题解析:金属钠长期露置在空气中首先与氧气反应生成氧化钠,氧化钠和水发生反应生成氢氧化钠。氢氧化钠吸收水分得到氢氧化钠溶液,然后在吸收二氧化碳得到碳酸钠溶液,溶液的水分蒸发得到碳酸钠晶体。晶体风化最后得到碳酸钠粉末。
本题难度:一般
2、选择题 在一定的温度下,向饱和的烧碱溶液中放入一定量的过氧化钠,充分反应后恢复到原来的温度,下列说法正确的是(?)
A.溶液中Na+浓度增大,有O2放出
B.溶液中OH-总数不变,有O2放出
C.溶液的pH增大,有O2放出
D.溶液中Na+总数减少,有O2放出
参考答案:D
本题解析:饱和溶液中的水,参加化学反应,使钠离子的浓度减少,析出更多的氢氧化钠。
本题难度:简单
3、选择题 能为高空或海底作业提供氧气的物质是
A.KClO3
B.KMnO4
C.Na2O2
D.H2O
参考答案:C
本题解析:Na2O2是很好的供氧剂,在常温下,能和二氧化碳或者水反应,生成氧气。所以,能为高空或海底作业提供氧气的物质是Na2O2,选C。
本题难度:简单
4、选择题 将一定量的NO2通入足量的小苏打溶液中,使逸出的气体全部通过足量的Na2O2,充分反应后,剩余气体为(? )
A.O2
B.NO2、O2
C.NO2、NO
D.NO2、CO2
参考答案:B
本题解析:本题是利用物质之间的关系进行的计算。思路如下:
3NO2+H2O====2HNO3+NO
HNO3+NaHCO3====NaNO3+CO2↑+H2O
2CO2+2Na2O2====2Na2CO3+O2
2NO+O2====2NO2
2HNO3—2CO2—O2
所以NO与O2之比为1∶1,所以充分反应后得到的气体是NO2、O2。
本题难度:简单
5、填空题 我国濒临海域的省份,能够充分利用海水制得多种化工产品。下图是以海水、贝壳(主要成分CaCO3)等为原料制取几种化工产品的工艺流程图,其中E是一种化肥,N是一种常见的金属单质。
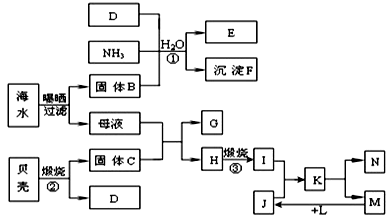
结合上述工艺流程回答下列问题:
(1)物质G和L的化学式分别为?和???;固体B是生活中的一种必需品,主要用作 ??
(2)上述工艺流程中可以循环使用的物质的化学式为??
(3)反应①的化学方程式为?;在反应①中必须先通入NH3,而后通入D,其原因是?
(4)工业上利用F可制得另一种化工产品,该反应的化学方程式为?
(5)由K溶液经如何处理才能制得N??
参考答案:(1)CaCl2? H2?调味品
(2)CO2
(3)NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl? NH3在溶液中的溶解度大,利于吸收CO2,使其转化为(NH4)2CO3
(4)2NaHCO3 Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
(5)MgCl2溶液必须在氯化氢气体中进行蒸发结晶制得MgCl2晶体,熔融电解可制取金属镁
本题解析:贝克高温煅烧得到CaO和CO2。海水曝晒得到NaCl固体和含有CaCl2、MgCl2的母液。NaCl、CO2、NH3在水溶液中发生反应:NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl产生小苏打沉淀。滤液中含有NH4Cl。将CaO加入含有MgCl2溶液中,发生反应:CaO+ MgCl2+H2O=Mg(OH)2↓+ CaCl2. 将过滤出来,洗涤干净,然后灼烧Mg(OH)2,发生分解反应Mg(OH)2 MgO+ H2O。用HCl溶解MgO,得到纯净的MgCl2溶液。将该溶液蒸发、浓缩,冷却结晶得到MgCl2·6H2O.将MgCl2·6H2O加热,在HCl的气氛中加热蒸发得到无水MgCl2。然后电解熔融的Mg Cl2即得到Mg和Cl2.(1)物质G和L的分别为CaCl2和H2。固体NaCl是生活中的一种必需品,主要用作调味品。(2)上述工艺流程中可以循环使用的物质的化学式为CO2。(3)反应①的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。在反应①中必须先通入NH3,而后通入CO2,是因为NH3在溶液中的溶解度大,利于吸收CO2,使其转化为(NH4)2CO3。(4)工业上利用NaHCO3可制得另一种化工产品Na2CO3,该反应的化学方程式为2NaHCO3
MgO+ H2O。用HCl溶解MgO,得到纯净的MgCl2溶液。将该溶液蒸发、浓缩,冷却结晶得到MgCl2·6H2O.将MgCl2·6H2O加热,在HCl的气氛中加热蒸发得到无水MgCl2。然后电解熔融的Mg Cl2即得到Mg和Cl2.(1)物质G和L的分别为CaCl2和H2。固体NaCl是生活中的一种必需品,主要用作调味品。(2)上述工艺流程中可以循环使用的物质的化学式为CO2。(3)反应①的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl。在反应①中必须先通入NH3,而后通入CO2,是因为NH3在溶液中的溶解度大,利于吸收CO2,使其转化为(NH4)2CO3。(4)工业上利用NaHCO3可制得另一种化工产品Na2CO3,该反应的化学方程式为2NaHCO3 Na2CO3+ CO2↑+H2O。(5)MgCl2是强酸弱碱盐,加热发生水解反应得到Mg(OH) 2和HCl,HCl容易挥发,导致得到的固体为Mg(OH) 2。为了抑制其水解,所以必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,然后电解熔融氯化镁,可制取金属镁。
Na2CO3+ CO2↑+H2O。(5)MgCl2是强酸弱碱盐,加热发生水解反应得到Mg(OH) 2和HCl,HCl容易挥发,导致得到的固体为Mg(OH) 2。为了抑制其水解,所以必须在氯化氢气体中进行蒸发结晶制得无水MgCl2,然后电解熔融氯化镁,可制取金属镁。
本题难度:一般