1、实验题 (4分)取三份锌粉,分盛于甲、乙、丙三支试管中,分别加入以下物质后,及时塞上导管塞子,充分反应。甲加入50mLpH=2盐酸,乙加入50mL pH=2醋酸,丙加入50mL pH=2醋酸及少量的胆矾粉末。
(1)若反应终了甲和乙中产生氢气的体积一样多,且只有一支试管中金属有剩余,则开始时加入的锌的质量大小关系为?(以上用“甲、乙”和? “>?、 < 、 ="”" 回答)
(2)若反应终了生成氢气的体积一样多,且没有剩余的锌。回答以下问题。
①三支试管中参加反应的锌的质量大小关系为:?
(用“甲、乙、丙”和? “>?、 < 、 ="”" 回答)
②反应终了,所需时间为:? (同①)
③若以上三组实验,锌粉均过量,产生的氢气体积?(同①)
参考答案:(4分)(1)甲>乙? (2)①丙>甲=乙?②甲>乙>丙?③乙=丙>甲
本题解析:(1)醋酸属于弱酸,溶液中的醋酸部分电离,溶液中部分氢离子以醋酸分子的形式存在,所以体积相同,PH相同的醋酸和盐酸,醋酸实际含有的氢离子的物质的量大于盐酸实际含有的氢离子的物质的量,甲和乙两只试管产生氢气的体积一样多,说明醋酸没有反应完全,加入的锌粉不足;只有一支试管中金属有剩余,那么只能是盐酸的试管中金属剩余,如果是醋酸的试管中金属剩余那么产生的气体一定是乙管多,所以开始时加入的锌的质量大小关系为甲>乙。
(2)①反应终了生成氢气的体积一样多,甲和乙中只有锌粉与酸反应,生成的气体一样多根据得失电子守恒可以判断消耗的锌粉也应该一样多,甲=乙;三支试管中锌粉均没有剩余,而丙中含有硫酸铜溶液会与锌粉反应消耗锌粉,所以丙中加入的锌粉比较多,所以加入锌粉的质量大小为丙>甲=乙。②丙中存在硫酸铜,锌粉与其反应生成铜,进而形成原电池,所以反应最快,所需时间最短,乙中随着反应的进行溶液中的醋酸分子电离平衡向电离的方向进行,溶液中的氢离子得到了适当的补充,而甲试管中氢离子不断消耗浓度减小反应速率减小,反应最慢,所需时间最长。所以反应所需的时间为甲>乙>丙,③锌粉过量,三种溶液中的酸均完全反应,乙和丙中酸的含量是相同的所以生成的气体的量也相同,而乙和丙存在没有电离的醋酸分子,随着反应的进行,这一部分醋酸也会电离出氢离子,所以在锌粉过量的情况下生成的气体最多,甲中盐酸是强酸,不存在此过程所以产生的气体较少所以产生气体的顺序是乙=丙>甲。
本题难度:一般
2、填空题 (20分)
某芳香族化合物A的分子中含有C、H、O、N四种元素,相同状况下,其蒸气的密度氢气密度的68.5倍。现以苯为原料合成A,并最终制得F(一种染料中间体),转化关系如下:(一些非主要产物已略去)
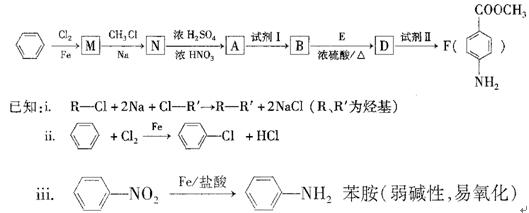
请回答下列问题:
(1)写出A的分子式?;A的结构简式?。
(2)N—A的反应类型是?。
(3)①上述转化中试剂I和试剂Ⅱ分别是:试剂I?;试剂Ⅱ?(选填字母)。
a.KMnO4(H+)? b.Fe/盐酸? c.NaOH溶液
②若上述转化中物质A依次与试剂II、试剂I、化合物E(浓硫酸/△)作用,能否得到F,为什么??。
(4)用核磁共振氢谱可以证明化合物E中含有?种处于不同化学环境的氢。
(5)写出同时 符合下列要求的两种D的同分异构体的结构简式一。
符合下列要求的两种D的同分异构体的结构简式一。
①属于芳香族化合物,分子中有两个:互为对位的取代基,其中一个取代基是硝基;
②分子中含有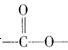 结构。
结构。
(6)有一种D的同分异构体W,在酸性条件下水解后,可得到一种能与FeCl,溶液发生显色反应的产物,写出W在酸性条件下水解的化学方程式
(7)F的水解反应如下:
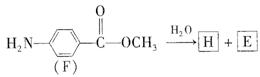
化合物H在一定条件下经缩聚反应可制得高分子纤维,广泛用于通讯、导弹、宇航等领域。请写出该缩聚反应的化学方程式?。
参考答案:
(1)C7H7NO2? …………2分
 ? …………2分
? …………2分
(2)取代反应? …………2分
(3)①a? …………1分
b? …………1分
②不可以,(1分)若先还原后氧化,则还原生成的氨基又会被氧化
…………1分
(4)2? …………2分
(5)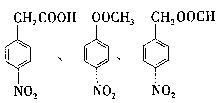 ……(每个2分,共4分,写出两个即可)
……(每个2分,共4分,写出两个即可)
(6) …2分
…2分
(7)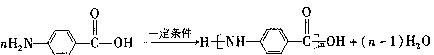 ……2分
……2分
(方程式不写条件或写“ ” 不扣分)
” 不扣分)
本题解析:略
本题难度:一般
3、实验题 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是?。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为?mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果?(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
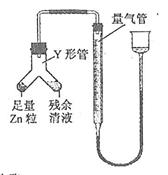
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将?转移到?中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是?(排除仪器和实验操作的影响因素)。
参考答案:(1)ACB(按序写出三项)?(2)①残余清液中,n(Cl-)>n(H+)(或其他合理答案)
② 0.1100? ③ 偏小? ④ (ⅰ)Zn粒?残余清液(按序写出两项)?(ⅱ) 装置内气体尚未冷至室温?
【考点定位】本题考查了化学实验方案基本操作、实验的设计与评价等,重在考查学生的实验能力和数据处理能力。
本题解析:(1)注意加药品时先加入固体MnO2,再通过分液漏斗加入浓盐酸,最后才能加热。
则依次顺序是ACB
(2)①根据反应的离子方程式:MnO2+4H++2Cl-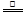 Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。
Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。
②根据c(盐酸)×V(盐酸)=c(氢氧化钠)×V(氢氧化钠),c(盐酸)=c(氢氧化钠)×V(氢氧化钠)/ V(盐酸)="22.00mL×0.1000" mol·L-1/20.00mL="0.1100" mol·L-1。
③由于KSP(MnCO3)<KSP(CaCO3),过量的CaCO3要转化为一部分MnCO3,由于M(MnCO3)>M(CaCO3),故最终剩余的固体质量增加,导致测得的c(H+)偏小。
④Zn与盐酸反应放热,因此,冷却后气体的体积将缩小。
本题难度:一般
4、选择题 过氧化氢是一种无色透明的无毒液体,是重要无机化工产品。试探究下列问题
(1)过氧化氢最适合贴上的一个标签是?。
 ?
?
(2)过氧化氢的制备方法很多,下列方法中原子利用率最高的是:?。
A. BaO 2 + H2SO 4 ="==" BaSO4 ↓ + H2O2
B. 2NH4HSO4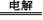 (NH4)2S2O8 + H2↑,
(NH4)2S2O8 + H2↑,
然后水解 (NH4)2S2O8 + 2H2O =2NH4HSO4 + H2O2。
C.CH3CHOHCH3+O2→CH3COCH3+H2O2
D.乙基蒽醌法:
(3)碱性氢氧燃料电池工作时可产生过氧化氢(见下左图),正极含碳(Carbon)的质量大小对产生过氧化氢的浓度(concentration)有影响(其影响曲线如下右图)。
 ?
?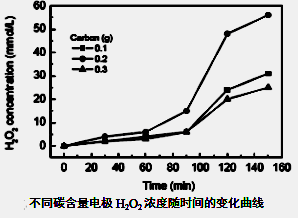
下列说法正确的有?。
A.开始时速率均较慢,说明电极有一个活化的过程
B.一段时间后,速率又再次平缓,说明生成与分解逐渐趋向平衡
C.正极室流出液经酸化后可分离出过氧化氢
D.正极含碳的质量以0.2g适宜
(4)过氧化氢作为一种绿色氧化剂有广泛应用,请写出下列反应的化学方程式:
①在过氧化氢作用下,铜与稀硫酸制硫酸铜:?。
②用Ti-Si分子筛作催化剂,甲苯被过氧化氢氧化为间-甲苯酚:?。
参考答案:
(1)B(2)D(3)ABCD (4)①Cu+H2SO4+H2O2=CuSO4+2H2O;
②H2O2 +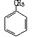
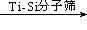
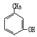 +H2O;
+H2O;
本题解析:
本题考查过氧化氢的制备。(2)D选项的物质可以循环利用,原子利用率最高;(3)从曲线可以看出,0~90minH2O2含量不高,90min后增大较快,A选项正确;120min后,生成速率减慢,说明生成与分解逐渐趋向平衡,B选项正确;正极反应为:H2O+O2+2e-=HO2-+OH-,生成的HO2-结合H+后产生H2O2,C选项正确;从三个曲线比较来看,正极含碳的质量0.2g时,H2O2的产率最高,D选项正确。(4)H2O2作为强氧化剂。
本题难度:一般
5、填空题 某废液中主要含有NaCl、NaI,实验室从该废液中回收I2和NaCl的流程如下:
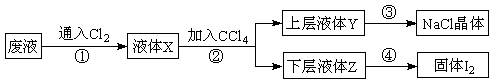
回答下列问题:
(1)在步骤①中通入的Cl2与NaI发生置换反应生成I2,其反应的化学方程式为
__________________________________________________________________________。
(2)步骤②操作名称是 ?,用到的玻璃仪器有________________________。
(3)下层液体Z的颜色是?,步骤④操作的名称是??。
(4)要从上层液体Y中得到NaCl晶体,步骤③操作中需要的实验仪器有_______________。
A.试管
B.蒸发皿
C.漏斗
D.玻璃棒 E.坩埚 F.酒精灯 G.烧瓶
参考答案:
(1)Cl2 + 2 NaI=2NaCl+ I2(3分)
NaI=2NaCl+ I2(3分)
( 91Exam.org2)萃取、分液(2分)?分液漏斗、烧杯(2分)
(3)紫色(或紫红色)?蒸馏(各1分)
(4)B D F(3分)
本题解析:
略
本题难度:简单