1、选择题 下列各组气体中,在通常情况下既能用浓硫酸又能用碱石灰干燥的有 (? )
A.SO2、O2、N2
B.HCl、Cl2、CO2
C.CH4、H2、CO
D.SO2、Cl2、O2
参考答案:C
本题解析:浓硫酸具有酸性和氧化性,碱石灰具有碱性。SO2、氯化氢、氯气、CO2都不能被碱石灰干燥,所以正确的答案选C。
点评:该题是基础性试题的考查,属于高考中的常见考点,难度不大。该题的关键是明确各类干燥剂的性质以及气体的性质,然后灵活运用即可。
本题难度:一般
2、实验题 实验室常见的几种气体发生装置A、B、C所示:
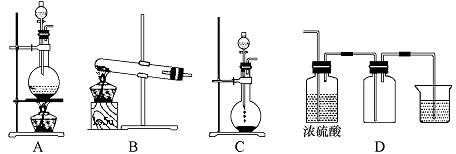

 (1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是?。检查C装置气密性是否良好的操作方法是?
(1)实验室可以用B和C装置制取氨气,如果用C装置,通常使用的药品是?。检查C装置气密性是否良好的操作方法是?
?。
(2)气体的性质是气体收集方法选择的主要依据。下列性质与收集方法无关的是?
?(填序号,下同)
①密度?②颜色?③溶解性?④热稳定性?⑤与氧气反应
(3)若用A装置与D装置相连制取并收集X气体,则X可能是下列气体中的?。
①CO2?②NO?③Cl2?④H2
参考答案:(1)浓氨水、CaO固体(NaOH固体或碱石灰);将导管与一导管连接,其末端放入水中,关闭分液漏斗活塞,用手(或热毛巾)捂住烧瓶,若导管末端有气泡产生,移开手(或热毛巾),若水中的导管产生一段水柱,则装置的气密性良好;(2)②④;(3)③。
本题解析:(1)利用装置C的特点,不需要加热来制取氨气,则可选用浓氨水、CaO固体(NaOH固体或碱石灰);装置C气密性的检验方法为:将导管与一导管连接,其末端放入水中,关闭分液漏斗活塞,用手(或热毛巾)捂住烧瓶,若导管末端有气泡产生,移开手(或热毛巾),若水中的导管产生一段水柱,则装置的气密性良好;(2)气体收集时,要依据气体的密度的大小(如H2、Cl2)、是否溶解于水(如H2、HCl)、是否与氧气反应(若NO)等来选择判断收集方法;(3)利用装置A制取的气体需要加热,利用装置D收集的气体是密度比空气的大的,则依据这两个条件,提起③Cl2符合。
本题难度:简单
3、选择题 仅用下表提供的仪器和药品,就能达到相应实验目的的是
编号
| 仪器
| 药品
| 实验目的
|
A
| 托盘天平(带砝码)、250mL容量瓶、量筒、烧杯、药匙、玻玻棒
| NaOH固体、蒸馏水
| 配制250mL一定物质的量浓度的NaOH溶液
|
B
| 分液漏斗、锥形瓶、导管及橡皮塞
| 稀硫酸、碳酸钠、硅酸钠溶液
| 证明非金属性;S>C>Si
|
C
| 碱式滴定管、酸式滴定管、胶头滴管、铁架台(带铁夹)、锥形瓶
| 己知浓度的NaOH溶液、待测盐酸、蒸馏水、白纸
| 测定稀盐酸的物质的量浓度
|
D
| 铁架台(带铁夹)、酒精灯、大试管、集气瓶、导管及橡皮塞
| 氯化铵
| 制取氨气
参考答案:B
本题解析:A.配制250mL一定物质的量浓度的NaOH溶液,需要使用的仪器有托盘天平(带砝码)、250mL容量瓶、量筒、烧杯、药匙、玻玻棒、胶头滴管。错误。B。元素的非金属性越强,其最高价氧化物对应的水化物的酸性就越强。根据复分解反应的规律:强酸与弱酸的盐反应制取弱酸。正确。C.测定稀盐酸的物质的量浓度,给定的药品中缺少待测HCl溶液、酸碱指示剂。错误。D.在实验室制取氨气要用氯化铵与氢氧化钙固体,缺少药品氢氧化钙。错误。
本题难度:简单
4、选择题 下图中a、b、c表示相应仪器中加入的试剂,可用下图装置制取、净化、收集的气体是
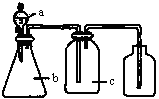
编号
| 气体
| a
| b
| c
| A
| NH3
| 浓氨水
| 生石灰
| 碱石灰
| B
| CO2
| 盐酸
| 碳酸钙
| 饱和NaHCO3
| C
| NO
| 稀硝酸
| 铜屑
| H2O
| D
| NO2
| 浓硝酸
| 铜屑
| NaOH溶液
|
?
参考答案:B
本题解析: A、NH3不能用向上排气法收集,错误;B、用饱和NaHCO3除去CO2中混有HCl,CO2能用向上排气法收集,正确;C、NO接触氧气会被氧化为NO2,错误。D、NaOH溶液会与NO2反应,错误。
本题难度:一般
5、实验题 实验室常用MnO2与浓盐酸反应制备Cl2(发生装置如右图所示)。

(1)制备实验开始时,先检查装置气密性,接下来的操作依次是_(填序号)
A.往烧瓶中加人MnO2粉末
B.加热
C.往烧瓶中加人浓盐酸
(2)制备反应会因盐酸浓度下降而停止。为测定反应残余液中盐酸的浓度,探究小组同学提出下列实验方案:
甲方案:与足量AgNO3溶液反应,称量生成的AgCl质量。
乙方案:采用酸碱中和滴定法测定。
丙方案:与已知量CaCO3(过量)反应,称量剩余的CaCO3质量。
丁方案:与足量Zn 反应,测量生成的H2体积。
继而进行下列判断和实验:
① 判定甲方案不可行,理由是?。
② 进行乙方案实验:准确量取残余清液稀释一定倍数后作为试样。
a.量取试样20.00 mL,用0 . 1000 mol·L-1 NaOH标准溶液滴定,消耗22.00mL,该次滴定测得试样中盐酸浓度为?mol·L-1
b.平行滴定后获得实验结果。
③ 判断丙方案的实验结果?(填“偏大”、“偏小”或“准确”)。
[已知:Ksp(CaCO3 ) = 2.8×10-9、Ksp(MnCO3 ) = 2.3×10-11
④ 进行丁方案实验:装置如右图所示(夹持器具已略去)。
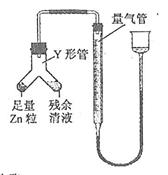
(i) 使Y形管中的残余清液与锌粒反应的正确操作是将?转移到?中。
(ii)反应完毕,每间隔1 分钟读取气体体积,气体体积逐次减小,直至不变。气体体积逐次减小的原因是?(排除仪器和实验操作的影响因素)。
参考答案:(1)ACB(按序写出三项)?(2)①残余清液中,n(Cl-)>n(H+)(或其他合理答案)
② 0.1100? ③ 偏小? ④ (ⅰ)Zn粒?残余清液(按序写出两项)?(ⅱ) 装置内气体尚未冷至室温?
【考点定位】本题考查了化学实验方案基本操作、实验的设计与评价等,重在考查学生的实验能力和数据处理能力。
本题解析:(1)注意加药品时先加入固体MnO2,再通过分液漏斗加入浓盐酸,最后才能加热。
则依次顺序是ACB
(2)①根据反应的离子方程式:MnO2+4H++2Cl-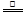 Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。 Mn2++Cl2↑+2H2O,可以看出反应残余液中c(Cl-)>c(H+),用甲方案测得的是c(Cl-),而不是(H+)。
②根据c(盐酸)×V(盐酸)=c(氢氧化钠)×V(氢氧化钠),c(盐酸)=c(氢氧化钠)×V(氢氧化钠)/ V(盐酸)="22.00mL×0.1000" mol·L-1/20.00mL="0.1100" mol·L-1。
③由于KSP(MnCO3)<KSP(CaCO3),过量的CaCO3要转化为一部分MnCO3,由于M(MnCO3)>M(CaCO3),故最终剩余的固体质量增加,导致测得的c(H+)偏小。
④Zn与盐酸反应放热,因此,冷却后气体的体积将缩小。
本题难度:一般
|