1、实验题 (8分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
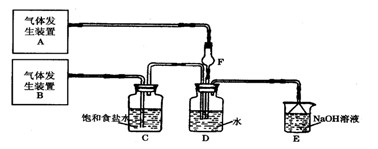
试填空。
(1)D装置中主要反应的离子方程式为?,
F仪器的作用是:?。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
 ?① 氯化铁稀溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液
?① 氯化铁稀溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液
④ 苯酚溶液? ⑤ 品红溶液? ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有?(选填一个序号)试剂的试管内,再加入?(选填一个序号)试剂,发生的现象是:?;
若SO2过量:取适量D中溶液滴加至盛有?(选填一个序号)试剂的试管内,发生的现象是:?。?
2、实验题 .(12分)在实验室中用二氧化锰跟浓盐酸反应制备干燥且较纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是(填各接口处的字母):
?接?,_____接?,_____接?,?接?。
(2)在装置中:
①饱和食盐水的作用是?,
②浓硫酸的作用是?。
(3)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:?;
②尾气吸收装置中进行的反应:?。
(4)MnO2是______色的粉末状固体,在该实验中MnO2所起得作用是____________
(5)若实验操作正确,在集气瓶内若放一块干燥的有色布条,在实验进行的过程中,有色布条能否褪色?(填“能”或“不能”)________.
3、实验题 (13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是?。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
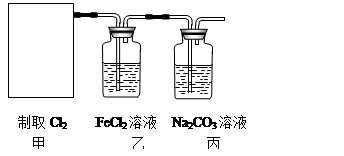
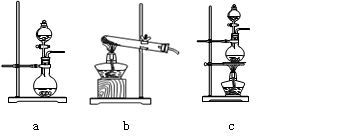
①在该实验中,甲部分的装置是?(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是?。证明FeCl2与Cl2发生了氧化还原反应的实验方法是?。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是?。
④该实验存在明显的缺陷,改进的方法是?。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为?。
4、实验题 (11分)下图为实验室制取、检验和收集纯净干燥的氯气的实验装置图:
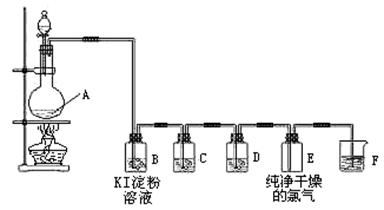
(1)装置A的化学方程式为:4HCl(浓)+MnO2 ?MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是?;
?MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是?;
(2)装置B中的现象是?,反应的化学方程式为?。
(3)装置C中所装试剂是饱和食盐水,作用是除去?;装置D中所装试剂是?,作用是?。
(4)装置F是氯气的尾气处理装置,发生反应的离子方程式?。
5、实验题 (12分)某研究性学习小组同学设计了如下图制取氯气并验证其性质的实验装置。
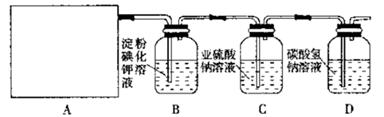
请回答下列问题:
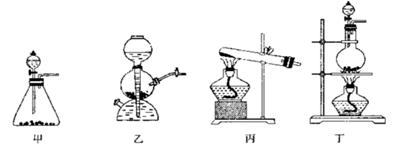
(1)该实验中A部分的装置是?(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是?;
整套实验装置存在的明显缺陷是?。
(3)写出D装置中发生反应的离子方程式:?。
(4)写出C装置中发生反应的离子方程式:?。请你帮该小组同学设计一个实验,证明洗气瓶C中的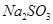 已被氧化(简述实验步骤):?
已被氧化(简述实验步骤):?