1、实验题 (8分)为了探究Cl2、SO2同时通入H2O中发生的反应,某校化学兴趣小组同学设计了如下图所示的实验装置。
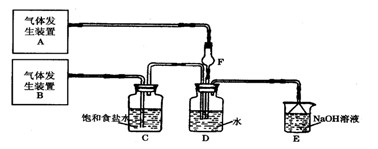
试填空。
(1)D装置中主要反应的离子方程式为?,
F仪器的作用是:?。
(2)为验证通入D装置中气体是Cl2还是SO2过量,兴趣小组的同学准备了以下试剂:
 ?① 氯化铁稀溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液
?① 氯化铁稀溶液? ② 氯化亚铁溶液? ③ 硫氰化钾溶液
④ 苯酚溶液? ⑤ 品红溶液? ⑥ 酸性高锰酸钾溶液
若Cl2过量:取适量D中溶液滴加至盛有?(选填一个序号)试剂的试管内,再加入?(选填一个序号)试剂,发生的现象是:?;
若SO2过量:取适量D中溶液滴加至盛有?(选填一个序号)试剂的试管内,发生的现象是:?。?
参考答案:
(1)Cl2+SO2+2H2O=4H++2Cl―+SO42―(1分),防倒吸(1分)
(2)? ②, ③(或④),溶液呈红色(或紫色)(3分)⑥,紫色褪去(3分)
本题解析:略
本题难度:简单
2、实验题 .(12分)在实验室中用二氧化锰跟浓盐酸反应制备干燥且较纯净的氯气。进行此实验,所用仪器如下图:

(1)连接上述仪器的正确顺序是(填各接口处的字母):
?接?,_____接?,_____接?,?接?。
(2)在装置中:
①饱和食盐水的作用是?,
②浓硫酸的作用是?。
(3)写出下列化学反应的化学方程式:
①气体发生装置中进行的反应:?;
②尾气吸收装置中进行的反应:?。
(4)MnO2是______色的粉末状固体,在该实验中MnO2所起得作用是____________
(5)若实验操作正确,在集气瓶内若放一块干燥的有色布条,在实验进行的过程中,有色布条能否褪色?(填“能”或“不能”)________.
参考答案:(共12分)
(1)E?接 C , D接 A , B接 H ,G 接 F。(2分)
(2)①?除去氯气中的HCl气体,(1分)
②除去氯气中的水蒸气,干燥氯气?。(1分)
(3)①:4HCl(浓)+MnO2 ?MnCl2 +Cl2↑ +2H2O;(2分)
?MnCl2 +Cl2↑ +2H2O;(2分)
②:Cl2 + 2NaOH =" NaCl" + NaClO + H2O(2分)
(4)黑,(1分)氧化剂(或类似的意思)(1分)
(5)不能(2分)
本题解析:考查氯气的制取、除杂、干燥及尾气吸收:其中一般用饱和食盐水来吸收氯化氢,浓硫酸来吸水,用碱液来吸收尾气
在实验原理中,MnO2是氧化剂,将盐酸中的氯元素氧化为氯气
干燥、除杂、集气时气体一般是长管进、短管出;
氯气本身并没有漂白性,只有当与水反应生成次氯酸时才具有漂白性,故经干燥后、在集气瓶中收集的氯气没有漂白性
本题难度:一般
3、实验题 (13分)氯气是一种重要的工业原料。
(1)实验室可用二氧化锰和浓盐酸反应制取氯气,反应的化学方程式是?。
(2)资料显示:Ca(ClO)2 +CaCl2+2H2SO4 2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
2CaSO4+2Cl2↑+2H2O。某学习小组利用此原理设计如图所示装置制取氯气并探究其性质。
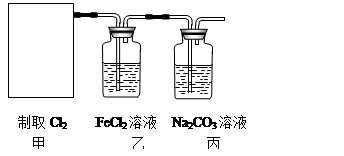
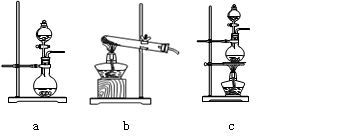
①在该实验中,甲部分的装置是?(填字母)。
②乙装置中FeCl2溶液与Cl2反应的离子方程式是?。证明FeCl2与Cl2发生了氧化还原反应的实验方法是?。
③丙装置中通入少量Cl2,可制得某种生活中常用的漂白、消毒的物质。已知碳酸的酸性强于次氯酸,则丙中发生反应的化学方程式是?。
④该实验存在明显的缺陷,改进的方法是?。
(3)为测定漂白粉中Ca(ClO)2的质量分数,该小组将2.0 g漂白粉配制成250 mL溶液,取出25 mL并向其中依次加入过量稀H2SO4、过量KI溶液,完全反应后,再滴入0.1 mol/L Na2S2O3溶液:2Na2S2O3+I2 ="==" Na2S4O6+2NaI,共消耗20 mL Na2S2O3,则漂白粉中Ca(ClO)2的质量分数为?。
参考答案:(1)MnO2 + 4HCl(浓)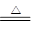 ?MnCl2 + Cl2↑+ 2H2O?
?MnCl2 + Cl2↑+ 2H2O?
(2)① c (1分)?②2Fe2++Cl2 ="==" 2Fe3++2Cl-
取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+ ,即FeCl2与Cl2发生了氧化还原反应(合理即得分)
③Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3
④在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶(合理即得分)?
(3)35.75%
本题解析:(1)方程式为MnO2 + 4HCl(浓)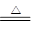 ?MnCl2 + Cl2↑+ 2H2O。
?MnCl2 + Cl2↑+ 2H2O。
(2)①根据反应原理可知,反应需要加热,硫酸是溶液,所以应该选择c装置。
②氯气具有氧化性,能把氯化亚铁氧化生成氯化铁,方程式为2Fe2++Cl2 ="==" 2Fe3++2Cl-。由于生成物是氯化铁,所以要证明FeCl2与Cl2发生了氧化还原反应,可以通过检验铁离子来证明。即取少量反应后的溶液置于洁净的试管中,向其中滴加KSCN溶液,若产生红色溶液,证明生成了Fe3+ ,即FeCl2与Cl2发生了氧化还原反应。
③由于碳酸的酸性强于次氯酸,所以反应中不可能生成CO2,因此方程式为Cl2+2Na2CO3+H2O ="==" NaCl+NaClO+2NaHCO3。
④由于氯气有毒,属于大气污染物,需要尾气处理,即应该在在丙装置后连接一个盛有氢氧化钠溶液的洗气瓶。
(3)次氯酸钙和碘化钾反应的方程式为ClO-+2I-+2H+=I2+Cl-+H2O,所以次氯酸钙和Na2S2O3的关系式为Ca(ClO)2~4Na2S2O3。所以25ml溶液中含有次氯酸钙的物质的量是0.1 mol/L×0.02L÷4=0.0005mol,质量是0.0005mol×143g/mol=0.0715g,所以质量分数是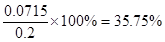 。
。
本题难度:一般
4、实验题 (11分)下图为实验室制取、检验和收集纯净干燥的氯气的实验装置图:
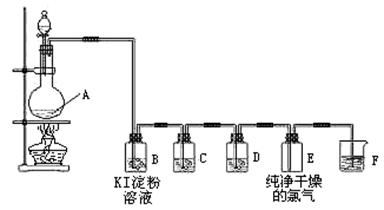
(1)装置A的化学方程式为:4HCl(浓)+MnO2 ?MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是?;
?MnCl2+C12↑+2H2O,在方程式上标出电子转移的方向和数目;该反应的氧化剂是?;
(2)装置B中的现象是?,反应的化学方程式为?。
(3)装置C中所装试剂是饱和食盐水,作用是除去?;装置D中所装试剂是?,作用是?。
(4)装置F是氯气的尾气处理装置,发生反应的离子方程式?。
参考答案:(1) 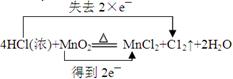 ?MnO2?
?MnO2?
(2)无色溶液变成蓝色? Cl2 +2KI=I2+2KCl
(3)除HCl、浓硫酸、除水蒸气?(4)Cl2+2OH-=Cl--+ClO--+H2O
本题解析:(1)MnO2的化合价降低,所以是氧化剂。
(2)氯气能将KI溶液中的I2置换出来,I2遇淀粉变蓝色,所以现象是溶液变蓝色。
(3)饱和食盐水主要除去混在氯气中的HCl,氯气中还有水蒸气,所以装置D中应该装有浓硫酸,除去水蒸气。
(4)装置F装的是NaOH溶液,发生的反应是Cl2+2OH-=Cl--+ClO--+H2O。
点评:本实验主要考查学生的基本实验能力,非常基础简单。
本题难度:一般
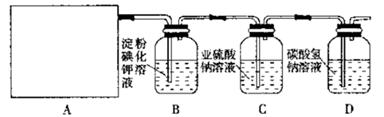
5、实验题 (12分)某研究性学习小组同学设计了如下图制取氯气并验证其性质的实验装置。
请回答下列问题:
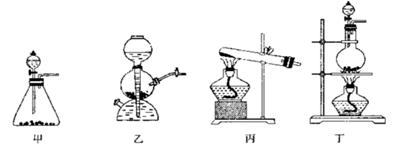
(1)该实验中A部分的装置是?(填写装置的序号)
(2)A中发生反应一段时间后,B中的现象是?;
整套实验装置存在的明显缺陷是?。
(3)写出D装置中发生反应的离子方程式:?。
(4)写出C装置中发生反应的离子方程式:?。请你帮该小组同学设计一个实验,证明洗气瓶C中的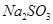 已被氧化(简述实验步骤):?
已被氧化(简述实验步骤):?
参考答案:(10分)
(1)丁(2分)
(2)溶液变蓝色(2分)无尾气吸收装置(2分)
(3)Cl2 + H2O==H+ + Cl- + HClO? (或用可逆符号)?(2分)
 (或
(或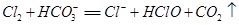 )
)
(4)取少量溶液置于洁净的试管中,向其中加入稀HCl至不再产生气体,再向其中滴入氯化钡溶液,若产生白色沉淀,则证明亚硫酸钠被氧化(2分)
本题解析:本题考查了氯气的制取及性质,其中每(4)小题考查SO42-的检验。
本题难度:一般