1、填空题 (1)氯化铝水溶液呈 性(填“酸性”,“中性”或“碱性”),原因是(用离子方程式表示): 。把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是(写化学式) 。实验室在保存AlCl3溶液时,常在溶液中加少量的 ,以 (填“促进”、“抑制”)其水解。
(2)将等体积等物质的量浓度的醋酸和氢氧化钠溶液混合后,溶液呈 性(填“酸性”,“中性”或“碱性”),溶液中c(Na+) c(CH3COO-)(填“ >” 或“=”或“<”)。
(3)25℃时,pH=3的醋酸和pH=11的氢氧化钠溶液等体积混合后溶液呈 性,(填“酸性”,“中性”或“碱性”)溶液中c(Na+) c(CH3COO-) (填“ >” 或“=”或“<”)。
(4) 物质的量浓度相同的醋酸和氢氧化钠溶液混合后,溶液中醋酸根离子和钠离子浓度相等,则混合后溶液呈 性,(填“酸性”,“中性”或“碱性”),醋酸体积 氢氧化钠溶液体积(填“ >” 或“=”或“<”)。
(5)已知0.1 mol·L-1的NaHCO3溶液PH=9,则溶液中c(CO32-) c(OH-) (填“ >” 或“=”或“<”),其溶液显电中性的原因 (用离子浓度关系式表示)。
参考答案:(1)酸,AI3++3H2O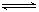 AI(OH)3+3H+ AI2O3 HCI 抑制
AI(OH)3+3H+ AI2O3 HCI 抑制
(2)碱, c(Na+)>c(CH3COO-)。(3)酸, c(Na+)<c(CH3COO-) 。
(4)中,>。(5)c(CO32-)<c(OH-),2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)
本题解析:(1)氯化铝是强酸弱碱盐,水解显酸性,方程式是AI3++3H2O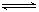 AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。
AI(OH)3+3H+。水解是吸热的,加热促进水解,且生成的氯化氢挥发,所以最终生成的是氢氧化铝,灼烧则得到氧化铝。所以实验室在保存AlCl3溶液时,常在溶液中加少量的盐酸,以抑制氯化铝的水解。
(2)醋酸和氢氧化钠的物质的量相等,恰好反应,生成醋酸钠。醋酸钠水解,溶液显碱性。所以根据电荷守恒定律可知,c(Na+)>c(CH3COO-)。
(3)由于醋酸是弱酸,所以pH=3的醋酸的浓度大于0.001mol/L,则在和氢氧化钠反应时,醋酸是过量的,所以溶液显酸性。所以根据电荷守恒定律可知,c(Na+)<c(CH3COO-)。
(4)根据电荷守恒定律可知,当溶液中醋酸根离子和钠离子浓度相等是,氢离子浓度等于OH-浓度,溶液显中性。这说明醋酸应该是过量的,所以醋酸的体积大于氢氧化钠溶液的体积。
(5)0.1 mol·L-1的NaHCO3溶液PH=9,这说明碳酸氢钠的水解程度大于碳酸氢钠的电离程度,所以溶液中c(CO32-)<c(OH-)。根据电荷守恒定律可知,离子浓度的关系是2c(CO32-)+c(OH-)+c(HCO3-)=c(Na+)+c(H+)。
本题难度:一般
2、选择题 “绿色化学”对化学反应提出了“原子经济性”(原子节约)的新概念及要求,理想的原子经济性反应是原料分子中的原子全部转化成所需要的产物,不产生副产物,实现零排放.下列反应类型中一定符合这一要求的是( )
①取代反应 ?②加成反应 ?③水解反应 ④酯化反应?⑤加聚反应.
A.②
B.①④
C.③⑤
D.②⑤
参考答案:D
本题解析:
本题难度:简单
3、选择题 修正液(俗称涂改液)白色纯正、反射率高且使用方便.由于修正液中含有挥发性的有毒液剂三氯乙烯等,所以应该尽量不要使用.以乙炔为原料,可以经过两步反应制得修正液中所含的该有毒成分,这两步反应的类型依次是( ? )
A.加成反应、取代反应
B.加成反应、消去反应
C.取代反应、消去反应
D.取代反应、加成反应
参考答案:B
本题解析:
本题难度:简单
4、选择题 下列溶液中有关微粒的物质的量浓度关系正确的是( )
A.常温下将醋酸钠、盐酸两溶液混合后,溶液呈中性,则混合后的溶液中:
c(Na+)>c(Cl-)> c(CH3COOH)
B.等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合
C(Na+)> C(K+)> C(SO42-)> C(HS-)> C(OH-)>C(H+)
C.pH <7的某二元弱酸的酸式盐NaHA溶液中有c(H+)+2 c(A2-)==c(OH-) +c (H2A)
D.用pH=3和pH=2的醋酸溶液中和含等量NaOH的溶液所消耗的醋酸溶液的体积分别为Va和Vb,则Va>10Vb
参考答案:D
本题解析:A、混合后的溶液呈中性,则有c(OH-)= c(H+),同时溶液满足电荷守恒,则有c(Cl-)+c(OH-)+c(CH3COO-)= c(H+)+ c(Na+),所以有c(Cl-)+ c(CH3COO-)= c(Na+),根据物料守恒可得c(CH3COOH)+ c(CH3COO-)= c(Na+),所以c(Cl-)= c(CH3COOH),错误;B、等物质的量浓度等体积的硫化钠溶液与硫酸氢钾溶液混合,二者的物质的量相等,所以C(K+)= C(SO42-),则离子浓度的大小关系是C(Na+)> C(K+)= C(SO42-)> C(HS-)> C(OH-)>C(H+),错误;C、二元弱酸的酸式盐NaHA溶液的pH<7,根据电荷守恒和物料守恒得c(H+)+ c(Na+)="2" c(A2-)+c(OH-) +c(HA-),c(Na+)= c(A2-)+c(H2A) +c(HA-),二者结合消去c(Na+),可得c(H+)+ c(H2A)= c(A2-)+c(OH-),错误;D、醋酸是弱酸,溶液越稀越易电离,所以pH=3与pH=2的醋酸溶液中前者溶液的浓度与后者的溶液浓度之比小于1:10,所以中和等物质的量的氢氧化钠时消耗的氢离子的物质的量相等,则消耗醋酸溶液的体积前者体积与后者体积之比大于10:1,Va>10Vb,正确,答案选D。
考点:考查溶液混合的判断
本题难度:一般
5、选择题 下表是在相同温度下,三种酸的一些数据,下列说法正确的是
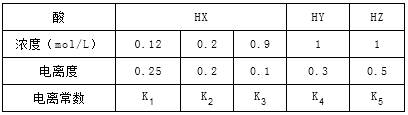
A.相同温度下,从HX的数据可以说明:弱电解质溶液浓度越低,电离度越大,且K1>K2>K3=0.1
B.室温时,若在NaZ溶液中加水,则c(Z-)/[c(HZ)×c(OH-)]的比值变小,若加少量盐酸,则比值变大
C.等物质的量的NaX、NaY和NaZ的混合,c(X-)+c(Y-)-2c(Z-)=2c(HZ)-c(HX)-c(HY),且c(Z-)<c(Y-)<c(X-)
D.相同温度下,K5>K4>K3