|
高中化学知识点大全《铁》高频试题巩固(2017年最新版)(十)
2017-11-11 03:05:20
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题
方案1 :向废液中加入过量的铁粉,充分反应后,过滤。?在所得滤渣中加入足量的盐酸,充分反后,再过滤即得到铜。
方案1中涉及的四种阳离子的氧化牲由强到弱的顺序为:_____________________过滤操作时,需要用到的玻璃仪器是:______________________
方案2:在废液中加入适量的盐酸调节溶液的pH=1,用铜和石墨作电极进行电解。当观察到阴极上有少量气泡产生时,即停止电解,这时要回收的Cu已全部析出。
方案2中铜作______极,所发生的电极反应为(若有多个电极反应,请按照反应发生的先后顺序全部写出)_______________________________________________________?另一电极所发生的电极反应为_____________________________?方案2在电极上直接回收铜,操作上比方案1简便,但方案2也有不足之处,主要表现为: ______________________
参考答案:①方案1:Fe3+>Cu2+>H+>Fe2+?漏斗、烧杯、玻璃棒方案2:阴? 2Fe3++2e-=2Fe2+;? Cu2++2e-="Cu" ;2H++2e-=H2↑;? 2Cl--2e-=Cl2↑有污染性气体Cl2产生?②使用了电解装置,成本较高等。
本题解析:本题以废液中回收Cu为素材,将氧化还原反应知识和电化学知识紧密的结合起来,方案1中同时考查了过滤操作。方案2是用电解的方法回收Cu,用铜和石墨作电极,铜要做阴极,阳离子在阴极得电子,因溶液中含有Fe3+、Cu2+、H+、Fe2+,所以存在得电子顺序问题,由方案1中知氧化性由强到弱的顺序为Fe3+>Cu2+>H+>Fe2+,故得电子顺序为Fe3+>Cu2+>H+>Fe2+,由题意知Fe3+、Cu2+、H+分别先后在阴极得电子。最后一问还从环保和经济方面考查了方案的不足。
本题难度:一般
2、填空题 (9分)铁是人类较早使用的金属之一。运用铁及其化合物的知识,完成下列各题。
(1)所含铁元素既有氧化性又有还原性的物质是(?)(用字母代号填)。
A.Fe
B.FeCl3
C.FeSO4
D.Fe2O3
| (2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,该分散系中微粒直径的范围是____________nm。
(3)电子工业需要用30%的FeCl3溶液腐蚀敷在绝缘板上的铜,制造印刷电路板。请写出FeCl3溶液与铜反应的化学方程式:__________________;检验反应后的溶液中存在Fe3+的试剂是_____________,该反应的离子方程式为__________________________。
参考答案:(1)C?(1分)(2)? 1~100?(每空2分)
(3)2FeCl3+Cu=2FeCl2+CuCl2; KSCN? Fe3++SCN-=[Fe(SCN)]2+(每空2分)
本题解析:(1)要让铁元素既有氧化性又有还原性,则其化合价必须处于中间价态。A、B、C、D四种物质中铁的化合价分别为0价、+3价、+2价和+3价。所以选项C正确。
(2)向沸水中逐滴滴加饱和FeCl3溶液,至液体呈透明的红褐色,此时所得的分散系属于胶体,微粒直径的范围是1~100nm。
(3)Fe3+具有氧化性,可氧化铜,方程式为2FeCl3+Cu=2FeCl2+CuCl2。检验Fe3+常用试剂是KSCN,现象是溶液变成红色,方程式为Fe3++SCN-=[Fe(SCN)]2+。
本题难度:一般
3、实验题 某氯化铁样品含有少量FeCl2杂质。现要测定其中铁元素的质量分数,实验按以下步骤进行:

(1)操作Ⅰ所用到的玻璃仪器除烧杯、玻璃棒外,还必须有________、________(填仪器名称)。
(2)写出加入氯水发生反应的离子方程式_____________________________________。
(3)检验沉淀已经洗涤干净的操作及现象是_____________________。
(4)坩埚质量为W1 g,加热后坩埚与红棕色固体总质量为W2 g,则样品中铁元素的质量分数是________ (列出原始算式,不需化简);若称量准确而最终测量的结果偏大,则造成误差的原因可能是_____________________________________________________________
(写出一种原因即可)。
参考答案:(1)100 mL容量瓶、胶头滴管
(2)2Fe2++Cl2=2Fe3++2Cl-
(3)取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;
(4) ×100% 固体加热时未充分反应变为Fe2O3 ×100% 固体加热时未充分反应变为Fe2O3
本题解析:(1)配制100 mL溶液,需用100 mL容量瓶,定容时使用胶头滴管;(2)氯气有强氧化性,能把二价铁离子氧化生成三价铁离子同时生成氯离子,离子方程式为2Fe2++Cl2=2Fe3++2Cl-。(3)检验沉淀已洗涤干净时,取少量最后一次洗涤液,滴加AgNO3溶液,若无沉淀生成,则证明洗涤干净;(4)红棕色固体是氧化铁,其质量是W2 g-W1 g,其中铁元素的质量是 g,样品中铁元素的质量分数是 g,样品中铁元素的质量分数是 ×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。 ×100%;固体加热时未充分反应变为Fe2O3会导致测量结果偏大。
本题难度:一般
4、填空题 (10分)过渡金属元素氧化物应用研究是目前科学研究的前沿之一,回答下列问题:

Ⅰ、二氧化钛作光催化剂能将居室污染物甲醛、苯等有害气体可转化为二氧化碳和水,达到无害化。有关甲醛、苯、及水说法正确的是_____________。
A.苯分子中含有碳碳键的键能较大,不易发生化学反应
B.苯不能使酸性KMnO4溶液褪色,说明其分子中不含碳碳双键
C.甲醛的沸点比甲酸低,主要原因是甲酸分子间可以形成氢键
D.水分子稳定性高,是因为水分子间能形成氢键
Ⅱ、2007年诺贝尔物理学奖为法国科学家阿尔贝·费尔和德国科学家彼得·格林贝格尔共同获得,以表彰他们在巨磁电阻效应(CMR效应)研究方面的成就。某钙钛型复合氧化物(如右图),以A原子为晶胞的顶点,A位可以是+2价的Ca、Sr、Ba或Pb,当B位是V、Cr、Mn、Fe时,这种化合物具有CMR效应。
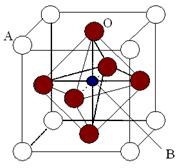
用A、B、O表示这类特殊晶体的化学式__________。(A、B为元素代号,O为氧元素)
⑵已知La为+3价,当被钙等二价元素A替代时,可形成复合钙钛矿化合物La1-xAxMnO3, (x < 0.1),此时一部分锰转变为+4价。导致材料在某一温度附近有反铁磁-铁磁、铁磁-顺磁转变及金属-半导体的转变,则La1-xAxMnO3中三价锰与四价锰的物质的量之比为:____________。(用含x的代数式表示)
⑶26Fe3+的核外电子排布式为:?。
⑷下列有关说法正确的是__________________。
A.镧、锰、氧分别位于周期表f、d、p区
B.晶体铬属于体心立方堆积,其堆积方式如右图:
C.锰的电负性为1.59 ,Cr的电负性为1.66,说明锰的金属性比铬强
参考答案:I、 ABC(2分,答对2个给1分,全对给2分)?
Ⅱ、(1)ABO3(2分)?(2)(1-x)/x(2分)
(3)[Ar]3d5?(2分)?(4)AC(2分)
本题解析:I:水分子稳定性高,是因为O元素的非金属性较强,共价键比较牢固,而水分子间的氢键只影响水的熔、沸点,而不影响水分子的稳定性。
II:该晶胞为立方体结构,其中A位于立方体顶点平均每个晶胞占A为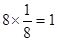 ,O位于体心平均每个晶胞占O为 ,O位于体心平均每个晶胞占O为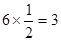 ,B位于体心平均每个晶胞占B为1,所以化学式为ABO3; ,B位于体心平均每个晶胞占B为1,所以化学式为ABO3;
La1-xAxMnO3中其化合价如图所示: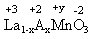 ,则根据正负化合价为0可求得y=3+x;+y为Mn的平均化合价,设+3价Mn物质的量为a mol 、+4价Mn物质的量为b mol;所以有等式a+b=1;3a+4b=3+x;解得 ,则根据正负化合价为0可求得y=3+x;+y为Mn的平均化合价,设+3价Mn物质的量为a mol 、+4价Mn物质的量为b mol;所以有等式a+b=1;3a+4b=3+x;解得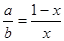
(3) 26Fe3+的核外电子排布式为:[Ar]3d5
(4)该图为面心立方最密堆积
本题难度:简单
5、选择题 在CuO和Fe粉的混合物中,加入一定量的稀硫酸,并微热,当反应停止后,滤出不溶物,并向滤液中插入一枚铁钉,发现铁钉并无任何变化。根据上述现象,确定下面结论正确的是
[? ]
A.不溶物一定是Cu
B.不溶物一定含铜,但不一定含铁
C.不溶物一定是Fe
D.溶液中有Fe2+,但不一定有Cu2+
参考答案:B
本题解析:
本题难度:一般
|