|
高考化学知识点总结《热化学方程式》高频试题巩固(2017年最新版)(四)
2017-11-11 03:06:52
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、选择题 C(s)?+?H2O(g)?==?CO(g)?+?H2(g);△H?=?+131.3?KJ/mol。它表示
[? ]
A.碳与水反应吸收131.3?KJ的热量
B.1mol固态焦炭与1mol水蒸气反应产生一氧化碳和氢气,吸收131.3?KJ的热量
C.1mol碳和1mol水反应吸收131.3?KJ的热量
D.固态碳和气态水各1mol反应,放出131.3?KJ的热量
参考答案:C
本题解析:
本题难度:简单
2、选择题 已知化学反应:①C(s)+1/2O2(g) = CO(g) △H1<0
②CO(g) +1/2O2(g) = CO2(g) △H2<0
③C(s)+O2(g) = CO2(g) △H3<0;
相同条件下,下列说法正确的是
A.56 g CO和32 g O2所具有的总能量大于88 g CO2所具有的总能量
B.反应②反应物的键能之和大于产物键能之和
C.△H1+△H2>△H3
D.△H3 >△H1 ,故CO2比CO稳定
|
参考答案:A
本题解析:反应式放热反应,所以反应前的总能量高于生成物的总能量,选项A正确;断键吸收的总能量和形成化学键所放出的总能量的差值是反应热,所以选项B不正确,应该是小于;根据盖斯定律可知,①+②即得到反应③,所以△H1+△H2=△H3,C不正确;碳完全燃烧放出的热量多,但放热越多,△H越小,所以△H3 <△H1 ,选项D不正确,答案选A。
本题难度:一般
3、填空题 应用化学反应原理知识解决下列问题
(1)某温度下纯水中c (H+) = 2.0×10-7 mol·L-1,则此纯水中的c (OH-) = 。
(2)将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+) 原来的十分之一(填“大于”、“小于”或“等于”)。
(3)0.1 mol·L-1的下列溶液①HCl、②CH3COOH、③CH3COONa、④FeCl3、⑤NaOH,其中pH最大的是 (填序号);实验室配制的氯化铁溶液显弱酸性的原因: (用离子方程式表示)。
(4)一定条件下22g二氧化碳气体与足量氢气反应生成气态甲醇(CH3OH)和水蒸气时,放出247.5kJ热量,其反应的热化学方程式为 。
参考答案:(1)2.0×10-7 mol·L-1(1分) (2)大于 (2分)
(3)⑤ (2分) Fe3++3H2O Fe(OH)3+3H+ (3分) Fe(OH)3+3H+ (3分)
(4)CO2(g)+3 H2(g)=CH3OH(g)+H2O(g ) △H=-495.0kJ·mol-1 (3分)
本题解析:(1)由于在任何的纯水中,水电离出的氢离子浓度总是等于水电离出的OH-浓度,因此某温度下纯水中c (H+)=2.0×10-7 mol·L-1,则此纯水中的c (OH-)=2.0×10-7 mol·L-1。
(2)醋酸是弱酸,存在电离平衡CH3COOH CH3COO-+H+。稀释促进电离,溶液中氢离子的物质的量增大,所以将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+)大于原来的十分之一。 CH3COO-+H+。稀释促进电离,溶液中氢离子的物质的量增大,所以将某CH3COOH溶液稀释10倍,则稀释后的溶液中c(H+)大于原来的十分之一。
(3)HCl是强酸,酸性最强,pH最小。CH3COOH是弱酸,溶液显酸性,pH小于7。CH3COONa是强碱弱酸盐,CH3COO-水解,溶液显碱性,pH大于7。FeCl3是强酸弱碱盐,铁离子水解溶液显酸性,pH小于7。NaOH是强碱,溶液的碱性最强,pH最大,因此pH最大的是⑤;FeCl3是强酸弱碱盐,铁离子水解溶液显酸性,离子方程式为Fe3++3H2O Fe(OH)3+3H+。 Fe(OH)3+3H+。
(4)22g二氧化碳的物质的量=22g÷44g/mol=0.5mol,此时反应放出的热量是247.5kJ,则1molCO2参加反应放出的热量是247.5kJ×2=495.0kJ,因此该反应的热化学方程式为CO2(g)+3 H2(g)=CH3OH(g)+H2O(g ) △H=-495.0kJ·mol-1。
考点:考查水的电离、盐类水解、稀释对电离平衡的影响、溶液pH大小比较以及热化学方程式的书写
本题难度:一般
4、填空题 X、Y、Z、W、T是元素周期表中前四周期的五种元素。有关这五种元素的信息如下表:
元素代号
| 相关信息
| X
| 它的一种核素的原子核内没有中子
| Y
| 能组成很多种性质不同的单质,也是形成化合物种类最多的一种元素
| Z
| 基态原子的最外层电子排布式为nsnnpn+1
| W
| 与钠元素能组成两种化合物,这些化合物与水反应均生成碱;大气平流层中W3被誉为地球生物“保护伞”
| T
| 主要化合价有+1和+2价,其二价离子在水溶液中呈蓝色
|
请推出具体元素,用化学用语回答下列问题:
(1)写出W元素在周期表中的位置____________。写出T元素的基态电子排布式________________。
(2)在这五种元素中电负性最大的是________,Y Z W三种元素的第一电离能顺序为_______________。
(3)由X Z 两种元素可以形成一种ZX5的既含离子键又含共价键的化合物,其电子式为__________。
(4)TW在高温条件下是一种优良的氧化剂,它能将很多有机化合物完全氧化(相当于完全燃烧),写出高温条件下,TW与Y最简单的氢化物反应的化学方程式:_______________________________________。
(5)已知在25℃、101 kPa下:
XYZ(aq)+X2W(1)  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
X3W+(aq)+WX(aq)=2X2W(1) ΔH="-57.3" KJ/mol
则在25℃、101 kPa的稀溶液中,XYZ与WX反应的热化学方程式(以离子方程式表示) :_________。
参考答案:(1)第二周期第ⅥA , 1S2 2S2 2P6 3S2 3P6 3d104s1
(2)O N >O >C
(3)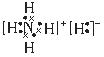
(4)CH4+4CuO  4Cu+CO2+2H2O 4Cu+CO2+2H2O
(5)HCN(aq)+OH-(aq)=CN-(aq)+H2O(1) ΔH="-11.7" kJ/mol
本题解析:根据题目提供的信息可知:X是H;Y是C;Z是N;W是O;T是Cu。(1)O元素在周期表中的位置是位于第二周期第ⅥA。29号元素是Cu。由于原子核外的电子在各个轨道上排布处于半充满、全充满或全空时是稳定的状态。所以Cu的基态电子排布式1S2 2S2 2P6 3S2 3P6 3d104s1。(2)元素的非金属性越强,其电负性最大。在这五种元素中非金属性最强的是O元素。所以电负性最大的是O。一般情况下,同一周期的元素,元素的原子半径越小,元素失去电子就越难,电离能就越大。但当原子核外的电子在各个轨道上排布处于半充满、全充满或全空时是稳定的状态。C、N、O三种元素的第一电离能顺序为N >O >C。(3)离子化合物NH5的电子式为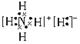 。(4)高温条件下,TW与Y最简单的氢化物反应的化学方程式:CH4+4CuO 。(4)高温条件下,TW与Y最简单的氢化物反应的化学方程式:CH4+4CuO  4Cu+CO2+2H2O。(5)将①+②,整理可得HCN(aq)+OH-(aq) =CN-(aq)+H2O(1) ΔH="-11.7" kJ/mol。 4Cu+CO2+2H2O。(5)将①+②,整理可得HCN(aq)+OH-(aq) =CN-(aq)+H2O(1) ΔH="-11.7" kJ/mol。
考点:考查元素的推断、原子的电子排布式、元素的位置、电子式的书写、电负性的比较、化学方程式、热化学方程式的书写的知识。
本题难度:困难
5、填空题 (6分)红磷P(s)和Cl2(g)发生反应生成PCl3(g)和PCl5(g)。反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。
根据下图回答下列问题:

(1)PCl5分解成PCl3和Cl2的热化学方程式____________
(2)P和Cl2分两步反应生成1molPCl5的△H3=_________,P和Cl2一步反应生成1molPCl5的△H4______△H3(填“大于”、“小于”或“等于”)。
参考答案:(1)PCl5(g) =PCl3(g)+Cl2(g);△H=93kJ·mol-1。 (2)-399kJ·mol-1;等于
本题解析:(1)由图可以看出,1mo PCl3和1molCl2反应生成PCl5是放热反应,放出的热量是93kJ,所以PCl5分解的热化学方程式为PCl5(g)=PCl3(g)+Cl2(g);△H=93kJ·mol-1。
(2)由盖斯定律可知,一步生成生成PCl5和两步生成PCl5的总热效应相等,即△H3=-306
kJ·mol-1-93 kJ·mol-1=-399kJ·mol-1。
本题难度:一般
|  YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol
YZ- (aq)+X3W+(aq) ΔH="+45.6" KJ/mol