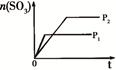
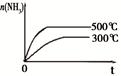
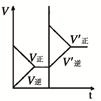
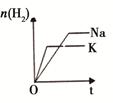
1、选择题 下列研究目的和示意图相符的是(? )
?
| A
| B
| C
| D
|
研
究
目
的
| 固定容积的密闭容器中,压强对反应:
2SO2(g)+O2(g)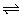 2SO3(g)的影响 2SO3(g)的影响
| 固定容积的密闭容器中,温度对反应:
N2(g)+3H2(g) 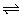 ?2NH3(g) ΔH< 0的影响 ?2NH3(g) ΔH< 0的影响
| 固定容积的密闭容器中,增大CO2浓度,对已达平衡的反应:
CO(g)+H2O(g)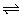 CO2(g)+H2(g)的影响 CO2(g)+H2(g)的影响
| 等质量Na、K 分别与足量水反应
|
示
意
图
| 
| 
| 
| 
|
?
参考答案:D
本题解析:A、P1时反应速率大,所以P1>P2,平衡时P1SO3的物质的量大于P2的SO3的物质的量,错误;B、温度升高,反应速率加快,平衡逆向移动,NH3的物质的量减小,错误;C、增大CO2的浓度,逆反应速率增大,平衡向逆反应方向移动,错误;D、K的活泼性大于Na,所以K与水的反应速率大,等质量Na、K 分别与足量水反应,K产生的H2少,错误。
本题难度:一般
2、填空题 在密闭容器中进行反应①Fe(s)+C02(g)  FeO(s)+CO(g) ΔH1=akJ·mol一
FeO(s)+CO(g) ΔH1=akJ·mol一
反应②2CO(g)+02(g)  2C02(g)?△H2="b" kJ·mol-
2C02(g)?△H2="b" kJ·mol-
反应③2Fe(s)+02(g)  2FeO(s)△H3
2FeO(s)△H3
(1) △H3=?(用含a、b的代数式表示)。
(2)反应①的化学平衡常数表达式K=?,已知500℃时反应①的平衡常数K=1.0,在此温度下2 L密闭容器中进行反应①,Fe和C02的起始量均为2.0 mol,达到平衡时CO2的转化率为??,CO的平衡浓度为?。
(3)将上述平衡体系升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,则a?0(填“>”、“<”或“=”)。为了加快化学反应速率且使体系中CO的物质的量增加,其他条件不变时,可以采取的措施有?(填序号)。
A.缩小反应器体积? B.再通入CO2? c.升高温度? D.使用合适的催化剂
(4)下列图像符合反应①的是?(填序号)(图中V是速率、φ为混合物中CO含量,T为温度)。

参考答案:(1)(2a+b)kJ?mol?1
(2)c(CO)/c(CO2)? 50%? 0.5mol?L?1
(3) >? BC?(4)C
本题解析:(1)根据盖斯定律,?H3=2?H1+?H2=(2a+b)kJ?mol?1
(2)反应①中Fe和FeO为固体,不计入平衡常数表达式,所以反应①的化学平衡常数表达式K= c(CO)/c(CO2);设CO2的转化浓度为X,则Fe(s)+C02(g)  FeO(s)+CO(g)
FeO(s)+CO(g)
起始浓度(mol?L?1)? 1? 0?
转化浓度(mol?L?1)? x? x
平衡浓度(mol?L?1)? 1—x? x
根据平衡常数,x÷(1—x)=1.0,解得x=0.5mol?L?1,CO的平衡浓度为0.5mol?L?1;则CO2的转化率为0.5mol?L?1 ÷0.5mol?L?1×100%=50%。
(3)升温至700℃,再次达到平衡时体系中CO的浓度是C02浓度的两倍,平衡向正反应方向移动,为吸热反应,所以a > 0;A、因为该反应气体的系数不变,缩小反应器体积,平衡不移动,CO的物质的量不变,错误;B、再通入CO2,反应物浓度增大,加快化学反应速率且使体系中CO的物质的量增加,正确;C、升高温度,反应速率加快,平衡向正反应方向移动,CO的物质的量增加,正确;D、使用合适的催化剂只能加快反应速率,CO的物质的量不变,错误。
(4)A、根据该图像可知升高温度,平衡向逆反应方向移动移动,与反应①不符合;B、平衡后再升高温度,CO的含量减小,平衡向逆反应方向移动移动,与反应①不符合;C、T1反应速率快,说明T1 > T2,T1时CO的平衡浓度大,说明温度升高,平衡向正反应方向移动,与反应不符合。
本题难度:一般
3、实验题 某化学学习小组借助下列装置(夹持装置已略)及相关试剂粗略测量空气中O2的体积百分数。
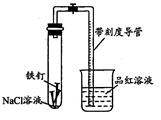
(1)实验前用碱液清洗铁钉,再用0.100mol/L的H2SO4溶液浸泡至有气泡产生。用H2SO4溶液浸泡的目的是_____ 。
(2)为尽量减小误差,下列操作的正确顺序是______ (填序号)。
①装人铁钉②插入注射器向铁钉表面滴入适量 NaCl溶液并打开止水夹③将导管口浸入品红溶液④塞 上单孔活塞⑤检查装置气密性
(3)实验中试管内发生的总反应为__ ____ ;用该实验方案测量空气中O2的体积百分数时应测量的数据是:①导管与试管内部空间总体积,②______ 。
(4) 实验时发现上述测量过程因反应较慢耗时较长,对其影响因素作如下分析,请补充 写出假设三:
假设一:电解质溶液的PH不同
假设二:NaCl溶液的浓度不同
假设三:
(5)借助上述实验装置,通过调节溶液的pH验证假设一,获得了如下实验数据:

①当pH=2时,没有观察到稳定液柱形成的原因是__ ____
②根据实验数据分析,为缩短实验测定时间,pH的最佳范围是______
③按上述实验装置,设计实验证明假设二。
第一步:___________ ;
第二步::相同温度下,加入系统表面积的铁钉,组装两套完全相同的上述装置,分别用注射器将NaCl溶液滴入铁钉表面;
第三步:记录形成稳定液柱所用时间和液柱的高度,比较分析数据得出结论。
参考答案:(1)除去铁钉表面的铁锈;
(2)⑤①④②③
(3)4Fe+3O2+6H2O=4Fe(OH)3;吸入导管内的品红溶液;
(4)铁钉的表面积(温度、催化剂)
(5)①溶液的酸性太强,铁容易发生析氢腐蚀;
②6.0<PH≤6.5
③配置不同浓度的NaCl溶液;
本题解析:(1) 铁钉表面由铁锈,可以用稀硫酸除去。(2) 试验装置装药品之前首先要检验气密性,(3) 氯化钠溶液显中性,铁钉在中性溶液中和氧气发生吸氧腐蚀,总反应为:4Fe+3O2+6H2O=4Fe(OH)3;随着反应的进行,试管内氧气减少,压强降低,在大气压的作用下,烧杯中的品红溶液进入带刻度导管,反应掉的氧气等于导管内的品红溶液的体积(4) 实验时发现上述测量过程因反应较慢耗时较长,说明反应速率慢,回答问题时应该从影响化学反应速率的因素方面答题;(5)①当pH=2时,溶液显酸性,铁钉发生析氢腐蚀,产生气体,液柱为0;②当PH的范围为:6.0<PH≤6.5反应的时间最短,产生的液柱最高。③假设二为NaCl溶液的浓度不同,首先要配置不同浓度的NaCl溶液。
考点: 钢铁腐蚀 影响化学反应速率的因素
本题难度:困难
4、选择题 在C(s)+CO2(g)=2CO(g)反应中,可使反应速率增大的措施是(?)
①增大压强;②增加炭的量;③通入CO2;④恒压下充入N2;⑤恒容下充入N2;⑥升温
①③④? B.②④⑥? C.①③⑥?D.③⑤⑥
参考答案:C
本题解析:影响化学反应速率的因素有:压强、温度、催化剂、浓度等因素。对于该反应,碳为固体,且反应为体积增大的反应。①增大压强,浓度增大,故反应速率增大。②增加碳的量,固体不影响浓度变化,故反应速率无变化。③通入二氧化碳,反应物浓度增加,反应速率增大。④恒压冲入氮气,体积增大,反应物浓度降低,反应速率降低。⑤恒容下冲入氮气,氮气不与反应物发生反应,反应物浓度不变,故无变化。⑥升高温度,反应速率增大。
本题难度:一般
5、选择题 下列关于化学反应速率的说法中正确的是( )
A.根据化学反应速率的大小可以知道化学反应进行的快慢
B.化学反应速率为0.8mol?L-1?s-1,是指1s时,物质的量浓度为0.8mol?L-1
C.对任何化学反应来说,反应速率越大化学现象越明显
D.化学反应速率是指一定时间内,任何一种反应物浓度的减少或任何一种生成物浓度的增加
参考答案:A.反应速率的大小衡量反应的快慢,则根据化学反应速率的大小可以知道化学反应进行的快慢,故A正确;
B.反应速率为平均速率,不是指1s时,应为1s内浓度变化量,故B错误;
C.反应速率与反应现象无关,反应速率快的可能现象不明显,如盐酸与NaOH反应,故C错误;
D.不能利用纯固体、纯液体表示反应速率,利用反应体系中浓度变化的反应物或生成物表示反应速率,故D错误;
故选:A.
本题解析:
本题难度:简单