1、计算题 草酸是一种重要的试剂。下面是利用草酸探究浓度对反应速率影响的实验。
(1)为证明浓度对反应速率的影响,曾有教科书《化学反应原理》设计了如下实验:取两支试管,各加入4mL0.01mol·L-1的KMnO4酸性溶液,分别向其中加入0.1 mol·L-1、0.2 mol·L-1 H2C2O4溶液2mL,记录溶液褪色所需时间。
实验中发生反应的离子方程式为:?;
预期现象是:
①溶液的颜色由?色变为?色,
②其中加入?mol·L-1H2C2O4的那支试管中的溶液先变色。
然而实验结果并不尽如人意。实验过程颜色复杂,且褪色先缓慢,后逐渐加快;最大的问题是草酸浓度大,反应速率却更慢。
本实验能否作为课堂实验研究浓度对化学反应速率的影响?适宜的条件是怎样的?某校一研究小组对此进行了探究。下面是他们的实验报告的一部分:
表1 试验安排及结果
实验
编号
| A(KMnO4溶液浓度/mol·L-1)
| B(草酸溶液浓度/mol·L-1)
| C(硫酸溶液浓度/mol·L-1)
| 褪色时间/s
|
1
| 3
| 3
| 1
| 336
|
2
| 1
| 2
| 3
| 82
|
3
| 3
| 1
| 3
| 76
|
4
| 1
| 3
| 2
| 133
|
5
| 2
| 3
| 3
| 102
|
6
| 3
| 2
| 2
| 156
|
7
| 2
| 2
| 1
| 300
|
8
| 2
| 1
| 2
| 115
|
9
| 1
| 1
| 1
| 200
|
?
应用SPSS16.0对正交试验结果进行方差分析,结果如下表
表2 各因素水平的数据处理结果
?
| A(KMnO4溶液)
| B(草酸溶液)
| C(硫酸溶液)
|
浓度/mol·L-1
| 0.005
| 0.010
| 0.015
| 0.1
| 0.5
| 0.9
| 6
| 12
| 18
|
平均褪色时间/s
| 138.3
| 172.3
| 189.3
| 130.3
| 179.3
| 190.3
| 278.7
| 134.7
| 86.7
|
?
(2)由表2可知,三因素中,?的浓度(选填“A、B或C”,下空同)对反应速率影响显著,而?的浓度对反应速率的影响不显著。
(3)由表2可知,当高锰酸钾浓度为?mol·L-1、草酸浓度为?mol·L-1时,反应最快。即因素A、B的较适宜实验条件得以确定。
根据以上实验结果,该小组同学继续探究硫酸的浓度是怎样影响本反应速率的,测得如下实验结果:
表3 不同硫酸浓度下的褪色时间
c(H2SO4)/mol·L-1
| 18
| 16
| 14
| 12
| 10
| 8
| 6
|
褪色时间/s
| 67
| 83
| 90
| 103
| 129
| 146
| 200
|
?
(4)根据课堂实验的合适时间,可选溶液的褪色时间约为1分钟和2分钟的两份溶液,即此时硫酸的浓度为?mol·L-1和?mol·L-1,这也有利于观察这两个反应速率的差异。
结论:草酸与酸性高锰酸钾溶液的反应,可作为课堂实验探究浓度对反应速率的影响。
参考答案:(14分)
(1)2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O(3分)
紫色(或紫红色)(1分);无(1分);0.2(2分)
(2)C(硫酸)? A(高锰酸钾)和B(草酸)(各1分,共3分)
(3)0.005 , 0.1(各1分,共2分);
(4)18,10(各1分,共2分)
本题解析:
(1)高锰酸钾具有氧化性、草酸具有还原性,MnO4-将H2C2O4氧化为CO2气体,本身被还原为Mn2+,根据得失电子相等、电荷守恒、质量守恒配平。MnO4-呈紫色,反应后溶液为无色。增大反应物浓度,反应速率加快。
(2)由表2可知,硫酸浓度对反应速率影响显著;而高锰酸钾和草酸浓度对反应速率影响不明显。
(3)当高锰酸钾溶液浓度为0.005 mol·L-1、草酸溶液浓度为0.01 mol·L-1时反应速率最快。
(4)褪色时间1分钟和2分钟即60s和120s,对应的浓度分别为18 mol·L-1和10 mol·L-1。
本题难度:一般
2、实验题 (5分)以下是实验室制取气体常用的化学仪器。
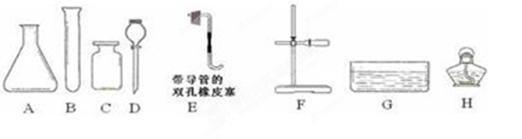
请回答以下问题:
(1)写出仪器F的名称?;
(2)写出实验室用双氧水和二氧化锰制取氧气的化学方程式?;制取大量氧气并用排水法收集时最好选用上述哪些仪器?(填字母);
(3)做铁丝在氧气中的燃烧实验时,在集气瓶底部加少量水的目的是:?;
(4)实验室通常用如右上图所示的洗气装置对氧气进行干燥,里面填装的药品可以是?(填字母)。
A.浓硫酸
B.氢氧化钠溶液
C.生石灰
D.氯化钠固体
参考答案:(1)铁架台?(2)2H2O2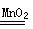 2H2O+O2↑? ACDEG或BCDEFG
2H2O+O2↑? ACDEG或BCDEFG
(3)防止生成的高温熔融物炸裂集气瓶?(4)A
本题解析:(1)根据F的构造可知,F是铁架台。
(2)双氧水不稳定,分解产生氧气和水,方程式为2H2O2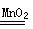 2H2O+O2↑。由于该反应不需要加热,因此H不需要。所以正确的选择是ACDEG或BCDEFG。
2H2O+O2↑。由于该反应不需要加热,因此H不需要。所以正确的选择是ACDEG或BCDEFG。
(3)铁丝在氧气中燃烧中放出大量的热,所以在集气瓶底部加少量水的目的是防止生成的高温熔融物炸裂集气瓶。
(4)干燥氧气常用浓硫酸作干燥剂,答案选A。
本题难度:一般
3、选择题 按下列实验方法能达到要求的是
A.用托盘天平称量25.20 g氯化钠固体
B.用100 mL量筒量取2.50 mL盐酸
C.用250 mL容量瓶配制0.1 mol·L-1150 mL盐酸
D.用100 mL烧杯配制溶液总体积为80 mL的食盐水
参考答案:D
本题解析:A项与B项它们的读数只能到小数点后1位;C项必须是配制250 mL.
本题难度:简单
4、选择题 有关实验操作正确的是( )
A.溴苯中混有溴:加入碘化钾溶液后分液
B.除去SO2中的少量CO2:通过盛有饱和Na2CO3溶液的洗气瓶
C.用玻璃棒在过滤器上搅拌以加速AgCl沉淀的洗涤
D.中和滴定实验中,锥形瓶用蒸馏水洗净后未干燥,不影响测定结果
参考答案:D
本题解析:A项中会引入新的杂质I2,错误;SO2可以和饱和Na2CO3溶液反应,B项错误;沉淀洗涤过程中搅拌会戳破滤纸,C项错误;锥形瓶内溶液中溶质的物质的量不变,改变溶液体积或浓度对测定结果无影响,D项正确。
本题难度:一般
5、选择题 关于下列各装置图的叙述中,不正确的是:
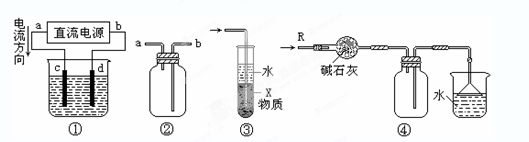
A.装置①中,c为阳极、d为阴极
B.装置②可用于收集H2、NH3、CO2、Cl2、HCl、NO2等气体,且从a口进气
C.装置③中X若为四氯化碳,可用于吸收氨气或氯化氢,并防止倒吸
D.装置④可用于干燥、收集氨气,并吸收多余的氨气
参考答案:B
本题解析:A、根据图①知,电源的正极是a,负极是b,所以电解池的阳极是c,阴极是d,正确;B、H2、NH3、CO2、Cl2、HCl、NO2等气体和氧气不反应且密度与空气相差较大,所以可以采用排空气法进行收集;H2、NH3的密度比空气小,采用向下排空气法进行收集,即导气管“短进长出”,CO2、Cl2、HCl、NO2的密度比空气大,采用向上排空气法进行收集,即导气管“长进短出”,错误;C、四氯化碳的密度大于水的密度且和水不互溶,所以四氯化碳和水混合会分层,氨气和氯化氢气体极易溶于水,且不溶于四氯化碳,所以四氯化碳有隔离作用,可以用此装置吸收NH3或HCl,并可防止倒吸,正确;D、碱石灰呈碱性所以能干燥碱性气体氨气,氨气的密度小于空气密度且和氧气不反应,所以可以用向下排空气法收集氨气,氨气极易溶于水,倒置的漏斗能防倒吸,所以可以用倒置的漏斗吸收氨气,正确。
本题难度:一般