1、选择题 对于物质的量相同的硫酸和磷酸,下列说法正确的是
A.分子数相同
B.氧原子数相同
C.原子总数相同
D.氢原子数相同
参考答案:AB
本题解析:物质的量相同的H2SO4和H3PO4的分子数相同,氧原子的物质的量相同,氧原子数也相同,但氢原子数及原子总数不同,其摩尔质量相同,质量亦相同,虽本题没有考查,但也应引起注意。
本题难度:困难
2、填空题 (14分) I、(1)下列物质中属于强电解质的是 ;(2)属于弱电解质的
是 ;(3)属于非电解质的是 。(填序号)
①氨气 ②氨水 ③盐酸 ④醋酸 ⑤硫酸钡 ⑥银 ⑦氯化钠 ⑧二氧化碳 ⑨醋酸铵 ⑩氢气
II、某反应体系中的物质有:Cr2(SO4)3、K2S2O8、K2Cr2O7、K2SO4、H2SO4、H2O。已知K2S2O8的氧化性比K2Cr2O7强。
(1)请将以上反应物与生成物编写成一个氧化还原反应方程式(要求配平)
(2)反应中,被还原的物质是 ,Cr2(SO4)3是 剂。
(3)在酸性条件下K2Cr2O7与草酸(H2C2O4)反应的产物是:Cr2(SO4)3、CO2、K2SO4和H2O,则还原剂与氧化剂物质的量之比为 。
参考答案:Ⅰ⑴⑤⑦⑨;④;①⑧
Ⅱ⑴7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7
⑵K2S2O8 还原剂
⑶3:1
本题解析:Ⅰ⑴混合物(②③)、单质(⑥⑩)既不是电解质也不是非电解质;强酸、强碱、绝大数盐(⑤⑦⑨)属于强电解质;弱酸(④)、弱碱、水等属于弱电解质;其余(①⑧)为非电解质。
Ⅱ根据 “K2S2O8的氧化性比K2Cr2O7强” 可确定该反应的氧化剂是K2S2O8,还原剂是K2Cr2O7;还原产物是H2SO4和K2SO4,氧化产物是K2Cr2O7,然后根据氧化还原的配平方法将其配平得7H2O+Cr2(SO4)3+3K2S2O8=7H2SO4+2K2SO4+K2Cr2O7;据此可回答⑴⑵小题;
⑶根据得失电子守恒得还原剂与氧化剂之间的系数关系为:3H2C2O4~1K2Cr2O7;则还原剂与氧化剂物质的量之比为3:1。
考点:考查氧化还原反应原理。
本题难度:一般
3、选择题 下列分子中,所有原子都处在同一平面的是
A.环已烷
B.丙烷
C.乙烷
D.苯
参考答案:D
本题解析:烷烃中的氢和碳不可能共面,苯中12个原子都共面。
本题难度:简单
4、填空题 (2分)有以下几个反应:
①CO2+2KOH=K2CO3+H2O;
②2FeCl2+Cl2=2FeCl3;
③2NaHCO3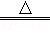 Na2CO3+H2O+CO2↑;
Na2CO3+H2O+CO2↑;
④CaCO3+H2O+CO2=Ca(HCO3)2;
⑤Cu+2FeCl3=CuCl2+2FeCl2.
其中属于氧化还原反应的是__________。
参考答案:②、⑤
本题解析:氧化还原反应的特征是反应前后是否有化合价的变化,如果有即为氧化还原反应,若没有则不是。分析化合价的关系,可知②中铁的化合价由+2价变为了+3价,升高了,氯元素的化合价由0价变为了-1价,降低了,为氧化还原反应;⑤中铜的化合价由0价升高到+2价,铁元素的化合价由+3价降低到+2价,为氧化还原反应;其余的化合价均没有发生变化,故应选择②、⑤。
考点:考查氧化还原反应方程式的判断,氧化还原反应的特征。
本题难度:一般
5、选择题 一定温度下的难溶电解质AmBn在水溶液中达到溶解平衡时。已知下表数据
A.向该溶液中加少量铁粉不能观察到红色固体析出
B.该溶液中c(SO42-):[c(Cu2+)+c(Fe2+)+c(Fe3+)]>5:4
C.向该混合溶液中逐滴加入NaOH溶液,最先看到红褐色沉淀
D.向该溶液中加入适量氯水,并调节pH值到3~4后过滤,得到纯净的CuSO4溶液
参考答案:D
本题解析:试题分析:A.因为Fe3+的氧化性强于Cu2+,所以投入少量铁粉,先发生的反应是:2Fe3++Fe=3Fe2+,不能观察到红色固体析出,正确; B.因为Cu2+、Fe2+、Fe3+对应的碱全是弱碱,所以这三种离子在溶液中都会发生水解,因此它们的物质的量会减少,正确; C.从表格中可以看出,Fe(OH)3的Ksp是最小的,所以它最先出现沉淀,正确; D.加入氯水,可以把亚铁离子全氧化成三价,但它的还原产物Cl-肯定还在溶液中,而且在调节pH时加入的试剂也会在溶液中有所保留,所以得到的溶液中不可能只含CuSO4一种溶质,错误。
考点:考查难溶电解质的溶解平衡以及转化
本题难度:一般