1、选择题 已知Mg(s)+Cl2(g)=MgCl2(s)ΔH=-642 kJ·mol-1,则
A.在任何温度下,反应都是自发的
B.在任何温度下,反应都不可能自发
C.高温下反应自发进行,低温下反应非自发进行
D.高温下反应非自发进行,低温下反应自发进行
参考答案:D
本题解析:
本题难度:简单
2、选择题 下列说法正确的是
A.检验溶液中是否含有SO42-时,在无其它阳离子干扰时,所加BaCl2溶液用盐酸酸化
B.铅笔芯的原料是重金属铅,儿童在使用时不可用嘴吮咬铅笔,以免引起铅中毒
C.证明CH3CH=CHCHO分子中有碳碳不饱和键的方法:加酸性高锰酸钾溶液,溶液褪色
D.薯片、薯条等淀粉类油炸食品中丙烯酰氨(CH2=CHCONH2)含量较高,可大量食用
参考答案:A
本题解析:分析:A、依据硫酸根离子的检验方法分析;
B、铅笔芯的成分是粘土和石墨混合而成;
C、依据分子中的双键和醛基都具有还原性,遇到强氧化剂会被氧化;
D、丙烯酰胺进入体内后,会在体内与DNA上的鸟嘌呤结合形成加合物,导致遗传物质损伤和基因突变.
解答:A、在无其它阳离子干扰时,加入钡盐生成不溶于水的白色沉淀可以证明硫酸根离子的存在,故A正确;
B、铅笔的笔芯是用石墨和粘土按一定比例混合制成的,不是金属铅,故B错误;
C、丙烯醛CH3CH=CHCHO中加入酸性高锰酸钾溶液,溶液褪色的原因可以是双键被氧化褪色,也可以分子中的醛基被氧化褪色,所以不能证明分子中含有碳碳不饱和键,正确的方法是先用银氨溶液把醛基氧化,再利用高锰酸钾溶液氧化双键来证明.故C错误;
D、薯片、薯条等淀粉类油炸食品中丙烯酰氨(CH2=CHCONH2)含量较高,丙烯酰胺具有潜在的神经毒性、遗传毒性和致癌性,因此食品中丙烯酰胺的污染引起了国际社会和各国政府的高度关注,不能大量食用,故D错误;
故选A.
点评:本题考查了硫酸根离子的检验方法,分子中双键和醛基的性质,铅笔芯的成分,丙烯酸胺的利弊分析和饮食安全,
本题难度:一般
3、选择题 下列反应转化关系(未配平)肯定不正确的是
A.S+KOH→K2SO3+K2S+H2O
B.FeO+HNO3→Fe(NO3)3+H2O
C.Cu2O+H2SO4→CuSO4+Cu+H2O
D.NH4NO3→N2+H2O
参考答案:B
本题解析:试题分析:A、S元素的化合价为0.,既有氧化性也有还原性,所以S与KOH反应生成K2SO3、K2S、H2O,正确;B、FeO具有还原性,HNO3应被还原为低价态物质,错误;C、Cu2O中Cu元素为+1价,既有氧化性也有还原性,所以Cu2O与H2SO4反应生成CuSO4、Cu和H2O,正确;D、NH4+中N元素为-3价,具有还原性,NO3?中N元素为+5价,具有氧化性,所以NH4NO3分解生成N2和H2O,正确。
考点:本题考查氧化还原反应规律和物质的性质。
本题难度:困难
4、选择题 下列分散系中分散质的微粒直径与纳米粒子具有相同数量级的是
A.溶液
B.胶体
C.悬浊液
D.乳浊液
参考答案:B
本题解析:溶液小于1nm,胶体1~100nm,浊液大于100nm。
本题难度:困难
5、填空题 金属冶炼和处理常涉及氧化还原反应。
(1)由下列物质冶炼相应金属时采用电解法的是 。
a.Fe2O3 b.NaCl c.Cu2S d.Al2O3
(2)辉铜矿(Cu2S)可发生反应2Cu2S+2H2SO4+5O2=4CuSO4+2 H2O,该反应的还原剂是 ,当1mol O2发生反应时,还原剂所失电子的物质的量为 mol。向CuSO4溶液中加入镁条时有气体生成,该气体是 。
(3)如图为电解精炼银的示意图, (填a或b)极为含有杂质的粗银,若b极有少量红棕色气体成,则生成该气体的电极反应式为 。
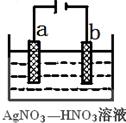
(4)为处理银器表面的黑斑(Ag2S),将银器置于铝制容器里的食盐水中并与铝接触,Ag2S转化为Ag,食盐水的作用为 。
参考答案:(1)b、d(2分,漏选得1分,错选或多选得0分)
(2)Cu2S(2分);4(2分);氢气(2分)
(3)a(2分);NO3-+e-+2H+=NO2↑+H2O(2分)
(4)做电解质溶液(或导电)(2分)
本题解析:(1)NaCl与Al2O3冶炼需要用电解法,Fe2O3与Cu2S可以用热还原法,选b、d
(2)在该反应中,Cu元素化合价由+1升高到+2,S元素化合价由-2升高到+6,Cu2S做还原剂;当有1molO2参与反应转移的电子为4mol,由于Cu2+水解呈酸性,加入镁条时,镁与H+反应生成了氢气。
(3)电解精炼时,不纯金属做阳极,这里就是a极;b电极是阴极,发生还原反应,生成了红棕色气体是NO,遇空气氧化生成的NO2,电极反应:NO3-+3e-+4H+=NO↑+2H2O。或NO3-+e-+2H+=NO2↑+H2O
(4)做电解质溶液,形成原电池。
考点:考查氧化还原反应、电化学等基础知识。
本题难度:困难