1、选择题 将2.3钠投入97.2g水中,所得溶液里溶质的质量分数是
A.2.3%
B.4%
C.2.3%与4%之间
D.大于4%
参考答案:D
本题解析:分析:钠与水反应生成氢氧化钠和氢气,钠在水中完全反应,溶质是氢氧化钠,溶液质量为总质量减去放出的氢气质量;根据概念即可求的;
解答:设2.3克金属钠与水反应生成氢氧化钠的质量为X,生成氢气质量为Y:
2Na+2H2O═2NaOH+H2↑
?46?80? 2
2.3g?X? ? Y
根据:46:80=2.3g:X
解得X=4g;
46:2=2.3g:Y
解得Y=0.1g,
反应后所得溶液的质量分数:4g÷(2.3g+97.2g-0.1g )×100%=4g÷99.4g×100%=4.02%,大于4%.
故选D.
点评:本题考查了溶液中溶质的判断,有的物质放入水中溶质已经变了,根据方程式的计算,质量守恒定律的应用.
本题难度:困难
2、选择题 欲使0.1 mol/L NaHCO3溶液中c(H+)、c(CO)、c(HCO)都减少,其方法是
A.通入二氧化碳气体
B.加入氢氧化钠固体
C.通入氯化氢气体
D.加入饱和石灰水溶液
参考答案:D
本题解析:试题分析:A项中有CO2+H2O H2CO3
H2CO3 H++HCO而使c(HCO)增大;B中反应是NaHCO3+NaOH=Na2CO3+H2O,c(CO)增大;C项中因HCl溶于水电离出H+而可能使c(H+)增大;D中反应是NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,故D符合要求,答案选D。
H++HCO而使c(HCO)增大;B中反应是NaHCO3+NaOH=Na2CO3+H2O,c(CO)增大;C项中因HCl溶于水电离出H+而可能使c(H+)增大;D中反应是NaHCO3+Ca(OH)2=CaCO3↓+H2O+NaOH,故D符合要求,答案选D。
考点:考查碳酸氢钠的化学性质
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,但更侧重对学生能力的考查。本题的关键是熟练记住碳酸氢钠的化学性质,然后灵活运用即可。
本题难度:困难
3、选择题 SO2使酸性KMnO4溶液褪色,体现了二氧化硫的
A.氧化性
B.还原性
C.漂白性
D.弱酸性
参考答案:B
本题解析:分析:酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子;
解答:酸性高锰酸钾能将二氧化硫在水溶液中氧化成硫酸,自身还原为无色的二价锰离子,是酸性高锰酸钾的氧化性的体现,这里体现的是二氧化硫的还原性,故选:B;
点评:本题考查二氧化硫的性质,掌握性质是解题的关键,难度不大.
本题难度:简单
4、选择题 金属钠着火时,可以灭火的物质是
A.水
B.砂子
C.煤油
D.二氧化碳
参考答案:B
本题解析:答案B。
金属钠着火时,可以B.砂子灭火。A中水与Na反应;C.煤油易燃;?D.二氧化碳能支持钠燃烧。
本题难度:一般
5、选择题 向某NaOH溶液中通人CO2气体后得溶液M,因CO2通入量的不同,溶液M的组成也不同.若向M中逐滴加人盐酸,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系有下列图示四种情况,且(2)中有OA<AB,(3)中有OA=AB,(4)中有OA>AB,则下列分析与判断不正确的是(不计CO2的溶解)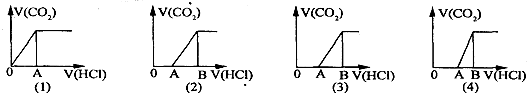
A.图(1)显示M中一定有:c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-)
B.图(2)显示M中一定有:c(NaHCO3)>c(Na2CO3)
C.图(3)显示M中一定有:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+)
D.图(4)显示M中的溶质是:NaOH和Na2CO3
参考答案:B
本题解析:分析:CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H20,
当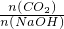 ≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
≥1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成生成NaHCO3,CO2有剩余;
当 <
<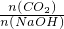 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当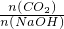 ≤
≤ ,反应按②进行,等于
,反应按②进行,等于 时,CO2、NaOH恰好反应生成Na2CO3;小于
时,CO2、NaOH恰好反应生成Na2CO3;小于 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;
向M中逐滴加入盐酸,根据溶液M中溶质不同,通过反应过程判断;
解答:由分析可知向NaOH溶液中通入CO2气体后得溶液M中溶质情况有:
(1)当含有两种溶质时,
①若溶质为Na2CO3、NaOH时,不能立即产生气体,滴加盐酸先中和氢氧化钠,然后与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积同碳酸氢钠与盐酸反应生成二氧化碳所消耗的盐酸体积相等,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为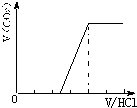 ;
;
②若为NaHCO3、Na2CO3,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积小于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为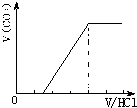 ;
;
(2)若只有一种溶质时,
①当溶质为Na2CO3时,不能立即产生气体,滴加盐酸先与碳酸钠反应生成碳酸氢钠,碳酸氢钠再与盐酸发生反应生成二氧化碳,且与碳酸钠反应生成碳酸氢钠消耗盐酸体积等于与碳酸氢钠反应生成二氧化碳所消耗的盐酸体积,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为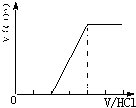 ;
;
②当溶质为NaHCO3时,滴加盐酸与碳酸氢钠反应生成二氧化碳,立即产生气体,产生的气体体积V(CO2)与加入盐酸的体积V(HCl)的关系为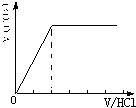 .
.
A、由上述分析可知,图(1)显示M中只有NaHCO3,碳酸氢根离子的水解大于电离,故c(Na+)>c(HCO3-)>c(OH-)>c(H2CO3)>c(CO32-),故A正确;
B、由上述分析可知,图(1)显示M中NaHCO3、Na2CO3,且NaHCO3的物质的量大于Na2CO3,则c(NaHCO3)<c(Na2CO3),故B错误;
C、由上述分析可知,图(1)显示M中只有Na2CO3,根据质子守恒可知:c(Na+)=c(HCO3-)+2c(CO32-)+c(OH-)-c(H+),故C正确;
D、由上述分析可知,图(1)显示M中有Na2CO3、NaOH,故D正确.
故选:B;
点评:本题考查学生金属钠的化合物的性质,可根据碳酸钠、碳酸氢钠、氢氧化钠分别与盐酸反应的化学方程式来计算,注意量的关系.
本题难度:简单