1、选择题 下列物质中,既能跟盐酸反应,又能跟NaOH溶液反应的是
A.Mg
B.Al
C.Si
D.Cl2
参考答案:B
本题解析:铝可以和酸和碱反应,镁只可以和酸反应,硅和强碱和HF反应,氯气和碱反应。
本题难度:简单
2、选择题 将5.6克Fe在一定量稀硝酸中恰好完全溶解后,往溶液中滴加KOH溶液立即产生沉淀,滴加至沉淀量最大时,再将所得溶液和沉淀一起加热蒸干,并在空气中灼烧至恒重,所得固体成分和可能的质量为
A.Fe2O3:8gKNO2:12.7g
B.Fe2O3:8gKNO2:20.4g
C.Fe2O3:8gKNO2:31.5g
D.FeO:7.2gKNO3:16.4g
参考答案:B
本题解析:分析:根据5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,5.6gFe的物质的量为0.1mol,加入氢氧化钾后蒸干,滴加至沉淀量最大时,溶液为硝酸钾溶液,得到0.1mol铁的氢氧化物(氢氧化亚铁会被空气氧化)和0.2mol硝酸钾或硝酸钾0.3mol,蒸干并在空气中灼烧至恒重,最后得到0.05mol氧化铁和0.2mol硝酸钾或0.3mol亚硝酸钾,可分别计算出亚硝酸钾的质量范围.
解答:5.6gFe的物质的量为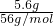 =0.1mol,
=0.1mol,
若铁全部恰好生成硝酸亚铁,根据铁元素守恒n[Fe(NO3)2]=n(Fe)=0.1mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据硝酸根子守恒可得n(KNO3)=2n[Fe(NO3)2]=2×0.1mol=0.2mol,
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.2mol×69g/mol=13.8g
若铁全部恰好生成硝酸铁,根据铁元素守恒n[Fe(NO3)3]=n(Fe)=0.1mol,
根据硝酸根子守恒可得n(KNO3)=3n[Fe(NO3)2]=3×0.1mol=0.3mol,
加入氢氧化钾后,加热蒸干,并在空气中灼烧至恒重,固体为氧化铁与硝酸钾.
根据铁元素守恒可得n(Fe2O3)= n(Fe)=
n(Fe)= ×0.1mol=0.05mol,
×0.1mol=0.05mol,
所以固体质量是:氧化铁0.05mol×160g/mol=8g,亚硝酸钾0.3mol×69g/mol=20.7g
所以氧化铁质量是8g,亚硝酸钾质量在13.8g~20.7g之间.
故选:B.
点评:本题考查混合物的计算,题目难度较大,注意本题考虑5.6gFe与稀硝酸反应可能生成硝酸亚铁或硝酸铁两种情况计算,利用端值法求解.
本题难度:困难
3、选择题 常温下,下列各组离子在指定溶液中可能大量共存的是
A.0.1mol/LNaHSO4溶液中:K+ ?NH4+?HCO3- NO3-
B.与铝反应产生氢气的溶液中:Na+?NH4+?SO42-?CH3COO-
C.由水电离产生的C(H+)=10-13mol/L的溶液中:Na+ NO3- ?SO42- CO32-
D.NaNO3溶液中:Fe2+ ?H+ ?Cl- ?I-
参考答案:C
本题解析:分析:A.离子之间结合生成水和气体;
B.与铝反应产生氢气的溶液,为酸或强碱溶液;
C.由水电离产生的C(H+)=10-13mol/L的溶液,为酸或碱溶液;
D.离子之间发生氧化还原反应.
解答:A.因LNaHSO4溶液中H+、HCO3-结合生成水和气体,则不能共存,故A错误;
B.与铝反应产生氢气的溶液,为酸或强碱溶液,酸溶液中H+、CH3COO-结合生成弱酸,碱溶液中OH-、NH4+结合生成弱碱,则不能共存,故B错误;
C.由水电离产生的C(H+)=10-13mol/L的溶液,为酸或碱溶液,碱溶液中该组离子不反应,能共存,故C正确;
D.NO3-、Fe2+、H+离子之间发生氧化还原反应,NO3-、I-、H+离子之间发生氧化还原反应,则不能共存,故D错误;
故选C.
点评:本题考查离子的共存,明确习题中的信息是解答本题的关键,注意选项D中发生的氧化还原反应为解答的难点,题目难度不 大.
本题难度:一般
4、选择题 下列电离方程式正确的是
A.H2SO4=H2++SO42-
B.AlCl3=Al3++3Cl-
C.Ba(OH)2=Ba2++(OH)2-
D.HNO3=H++N5++3O2-
参考答案:B
本题解析:分析:用化学式和离子符号表示电离过程的式子,称为电离方程式,表示物质溶解于水时电离成离子的化学方程式.离子所带电荷数一般可根据它们在化合物中的化合价来判断.所有阳离子带的正电荷总数与所有阴离子所带的负电荷总数相等.
解答:A、物质电离后角标要转化成化学计量数,同时注意离子所带的电荷数,正确的离子方程式为:H2SO4=2H++SO42-,故A错误;
B、氯化铝电离的离子方程式为:AlCl3=Al3++3Cl-,故B正确;
C、物质电离后角标要转化成化学计量数,同时注意离子所带的电荷数,正确的离子方程式为:Ba(OH)2=Ba2++2OH-,故C错误;
D、硝酸会电离出氢离子和硝酸根离子,硝酸根离子是一个整体,不能拆开,故D错误.
故选B.
点评:在解此类题时,首先分析应用的原理是否正确,然后再根据离子方程式的书写规则进行判断.
本题难度:困难
5、选择题 下列物质跟盐酸不能发生反应的是
A.碱式碳酸铜
B.硫酸氢钠
C.碳酸钠
D.双羟基铝碳酸钠
参考答案:B
本题解析:硫酸氢钠是强酸酸式盐,跟盐酸不反应。
本题难度:简单