1、填空题 Ⅰ.电离平衡常数(用K表示)的大小可以判断电解质的相对强弱。25℃时,有关物质的电离平衡常数如下表所示:
化学式
| HF
| H2CO3
| HClO
|
电离平衡常数
(K)
| 7.2×10-4
| K1=4.4×10-7
K2=4.7×10-11
| 3.0×10-8
|
?
(1)物质的量浓度均为0.1mol/L的下列四种溶液:①Na2CO3溶液 ②NaHCO3溶液 ③NaF溶液 ④NaClO溶液。依据数据判断pH由大到小的顺序是______________。
(2)25℃时,在20mL0.1mol·L—1氢氟酸中加入VmL0.1mol·L—1NaOH溶液,测得混合溶液的pH变化曲线如图所示,下列说法正确的是_______。
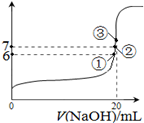
A.pH=3的HF溶液和pH=11的NaF溶液中,由水电离出的c(H+)相等
B.①点时pH=6,此时溶液中,c(F-)-c(Na+)=9.9×10-7mol/L
C.②点时,溶液中的c(F-)=c(Na+)
D.③点时V=20mL,此时溶液中c(F-)<c(Na+)=0.1mol·L—1
(3)已知25℃时,①HF(aq)+OH-(aq)=F-(aq)+H2O(l)? ΔH=-akJ·mol—1,
②H+(aq)+OH-(aq)=H2O(l)? ΔH=-bkJ·mol—1,
氢氟酸的电离方程式及热效应可表示为________________________。
(4)长期以来,一直认为氟的含氧酸不存在。1971年美国科学家用氟气通过细冰末时获得HFO,其结构式为H—O—F。HFO与等物质的量的H2O反应得到HF和化合物A,则每生成1molHF转移_______mol电子。
Ⅱ.氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点–54.1℃,沸点69.1℃。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:
SO2(g)+Cl2(g) SO2Cl2(l) ?△H=–97.3kJ·mol—1
SO2Cl2(l) ?△H=–97.3kJ·mol—1
(1)试写出常温常压下化学平衡常数K的表达式:K=_________________;
(2)对上述反应,若要使化学平衡常数K增大,化学反应速率v正也增大,可采取的措施是_____(选填编号)。
a.降低温度?b.移走SO2Cl2
c.增加反应物浓度?d.无法满足上述条件
(3)下列描述中能说明上述反应已达平衡的是____________(选填编号)。
a.υ(Cl 2)=υ(SO2)? b.容器中气体压强不随时间而变化?
c.c(Cl 2) : c(SO2)=1:1? d.容器中气体颜色不随时间两变化
(4)300℃时,体积为1L的密闭容器中充入16.20g SO2Cl2,达到平衡时容器中含SO2 7.616g。若在上述中的平衡体系中,再加入16.20g SO2Cl2,当再次达平衡时,容器中含SO2的质量范围是________________________。
2、选择题 (2014届江苏省南通市高三第二次调研化学试卷)
如图为一种微生物燃料电池结构示意图,关于该电池叙述正确的是
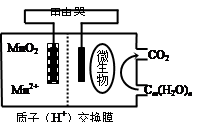
A.分子组成为Cm(H2O)n的物质一定是糖类
B.微生物所在电极区放电时发生还原反应
C.放电过程中,H+从正极区移向负极区
D.正极反应式为:MnO2+4H++2e—=Mn2++2H2O
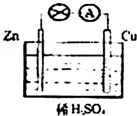
3、填空题 如图为Zn-Cu原电池的示意图,请回答:
(1)锌片为原电池的______(填“正”或“负”)极,该极的电极反应式是______.该反应属于______(填“氧化”或“还原”)反应.
(2)______(填“电子”或“电流”)从锌片通过导线流向铜片,溶液中H+的从______(填“锌片”或“铜片”)获得电子.
(3)原电池工作一段时间后,H2SO4溶液的浓度______(填“增大”或“减小”,下同),烧杯中溶液的质量______.
(4)若锌片质量减轻6.5g,则另一极放出气体的体积为______L(标准状况).
4、选择题 用酸性氢氧燃料电池为电源进行电解的实验装置如下图所示。下列说法正确的是( )
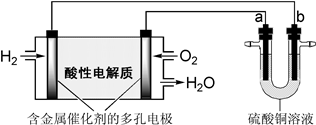
A.燃料电池工作时,正极反应为:O2+ 2H2O + 4e- ="==" 4OH-
B.若a极是铁,b极是铜时,b极逐渐溶解,a极上有铜析出
C.若a、b极都是石墨,在相同条件下a极产生的气体与电池中消耗的H2体积相等
D.若a极是粗铜,b极是纯铜时,a极逐渐溶解,b极上有铜析出
5、选择题 钢铁发生腐蚀时,正极上发生的反应是
A.2Fe-4e- = 2Fe2+
B.2Fe2++4e- = 2Fe
C.2H2O+O2+4e-= 4OH-
D.Fe3++e-= Fe2+