1、选择题 全社会都在倡导诚信,然而总是有一部分不法商贩在背道而驰。如有些商贩为了使银耳增白,就用硫黄(燃烧硫黄)对银耳进行熏制,用这种方法制取的洁白的银耳对人体是有害的。这些不法商贩增白银耳利用的是
[? ]
A.S的漂白性
B.S的还原性
C.SO2的漂白性
D.SO2的还原性
参考答案:C
本题解析:
本题难度:简单
2、选择题 为了除去SO2中的SO3,以制得纯的SO2,下列试剂最好选用(? )
A.石灰水
B.饱和NaHSO3
C.浓H2SO4(98.3%)
D.饱和Na2SO3溶液
参考答案:BC
本题解析:A项,石灰水与SO3、SO2均反应;B项,2NaHSO3+SO3 Na2SO4+H2O+2SO2↑;C项,H2SO4(浓)+xSO3
Na2SO4+H2O+2SO2↑;C项,H2SO4(浓)+xSO3 H2SO4·xSO3;D项,Na2SO3+SO2+H2O
H2SO4·xSO3;D项,Na2SO3+SO2+H2O 2NaHSO3。
2NaHSO3。
本题难度:简单
3、实验题 某课外活动小组的同学,在实验室研究用过量的锌与浓硫酸反应制取二氧化硫的有关问题。
(1)这样制取的二氧化硫气体中可能含有的杂质是?。
(2)某同学用下列装置连接成一整套实验装置以验证(1)的判断是否正确,若按气体从左到右流向时,气体流经的各装置导管的编号依次是?(用a、b……填写)。
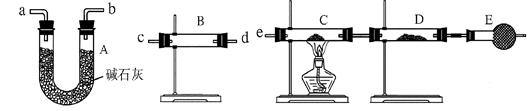
(3) 根据(2)确定的实验过程,请将实验时有关装置中所盛药品、实验现象、结论或解释填入下表:
装置
| 所盛药品
| 实验现象
| 结论或解释
|
B
| ?
| ?
| ?
|
C
| ?CuO固体
| ?
| ?
参考答案:(1) 氢气和水蒸气? (2)c d (或d c) a b (或b a) e
(3)
装置
所盛药品
实验现象
结论或解释
B
无水硫酸铜
固体由白色变成蓝色
SO2中含有水蒸气
C
?
固体由黑色变成红色
SO2中含有氢气
本题解析:(1)由于在反应过程中,浓硫酸的密度会逐渐减小,所以在反应后期会产生氢气。又因为气体从溶液中挥发出时一定会带有水蒸气,即SO2中含有的杂质是氢气和水蒸气。
(2)检验氢气可用其还原性,即利用氢气还原氧化铜;检验水蒸气一般用无水硫酸铜,且首先要检验水蒸气;又因为氢气在还原氧化铜时应该是干燥的,所以正确的答案是c d (或d c) a b (或b a) e
(3)见分析(2).
本题难度:一般
4、选择题 下列有关SO2说法中不正确的是
A.被酸雨污染的农田及湖泊可洒石灰石粉末;减轻其危害
B.在溶液BaCl2中通入SO2气体,溶液仍登清,滴入3%过氧化氢溶液有白色沉淀
C.能与水反应生成硫酸
D.二氧化硫能使品红溶液褪色,加热,品红溶液颜色恢复
参考答案:C
本题解析:SO2能与水反应生成亚硫酸。C错误;2的性质。
本题难度:一般
5、填空题 A、B、C、C、E是含有一种相同元素的五种物质,可发生如下转化关系:其中A是一种淡黄色粉末固体单质;B是气态氢化物;C、D是氧化物;E是该元素最高价氧化物对应的水化物。
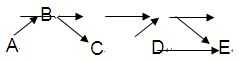
(1)元素A在元素周期表中的位置为?。
(2)B的名称是?。
(3)写出C的一种用途?;
C的水溶液在空气中放置一段时间后溶液的pH减少,试说明其原因?
?。
(4)D溶于水发生反应的离子方程式?。
(5)E的浓溶液与碳单质反应的化学方程式?。
参考答案:(11分)(1) 第三周期第ⅥA族?(2分)(2)?硫化氢 ?
(3)漂白剂等、亚硫酸为弱酸,不稳定易被氧化为硫酸(强酸),所以pH值减小(各1分)?(4)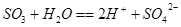 (3分) (3分)
(5)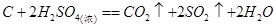 (3分) (3分)
本题解析:A是一种淡黄色粉末固体单质,则A是S单质。B是气态氢化物,则B是H2S。C、D是氧化物,则C是SO2,D是三氧化硫。E是该元素最高价氧化物对应的水化物,所以E是硫酸。
(1)S位于周期表的第三周期第ⅥA族。
(2)B是硫化氢。
(3)SO2检验漂白性,所以可以用作漂白剂。亚硫酸检验还原性,易被空气氧化生成强酸硫酸,所以pH值减小。
(4)三氧化硫溶于水即生成硫酸。
(5)浓硫酸检验强氧化性,在加热的条件下,能把碳氧化生成CO2,而硫酸被还原生成SO2。
点评:化学推断题是一类综合性较强的试题,如元素及化合物性质和社会生活,环境保护,化学计算等知识,还可引入学科间综合。它不仅可考察学生对化学知识的理解程度,更重要的是培养学生的综合分析能力和思维方法。解框图题的方法:最关键的是寻找“突破口”,“突破口”就是抓“特”字,例如特殊颜色、特殊状态、特殊气味、特殊反应、特殊现象、特殊制法、特殊用途等。
本题难度:一般
|