1、填空题 如图所示的装置,X、Y都是惰性电极。将电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色。试回答下列问题:
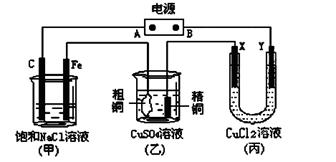
(1)在电源中,B电极为?极(填电极名称,下同);丙装置中Y电极为?极。
(2)在甲装置中,石墨(C)电极上发生?反应(填“氧化”或“还原”);甲装置中总的化学方程式是:?。
(3)丙装置在通电一段时间后,X电极上发生的电极反应式是?。
(4)如果乙装置中精铜电极的质量增加了0.64g,请问甲装置中,铁电极上产生的气体在标准状况下为
?L。
参考答案:(1)负极;阴极。?(2)氧化;2NaCl+2H2O 2NaOH+H2↑+Cl2↑
2NaOH+H2↑+Cl2↑
(3)2Cl--2e-=Cl2↑?(4)0.224L
本题解析:(1)由于电源接通后,向(甲)中滴入酚酞溶液,在Fe极附近显红色,说明在Fe电极附近的水溶液显碱性。则在该电极上是H+放电,所以根据同种电荷相互排斥,异种电荷相互吸引的原则Fe为阴极,与直流电源的负极相连。因此在电源中,B电极为负极,A电极为正极。在丙装置中Y电极为阴极。(2)在甲装置中,石墨(C)电极为电解池的阳极,在阳极上发生氧化反应。由于在NaCl溶液中放电能力Cl->OH-,所以在C上发生氧化反应2Cl—-2e-=Cl2↑. 甲装置中总的化学方程式是:2NaCl+2H2O Cl2↑+H2↑+2NaOH. (3)丙装置在通电一段时间后,阳极X电极上发生的电极反应式是2Cl--2e-=Cl2↑;(4)如果乙装置中精铜电极的质量增加了0.64g,n(Cu)=0.01mol。则n(e-)=0.02mol。由于在整个闭合回路中电子转移数目相等,所以铁电极上产生的氢气气体为0.01mol,在标准状况下为0.224L
Cl2↑+H2↑+2NaOH. (3)丙装置在通电一段时间后,阳极X电极上发生的电极反应式是2Cl--2e-=Cl2↑;(4)如果乙装置中精铜电极的质量增加了0.64g,n(Cu)=0.01mol。则n(e-)=0.02mol。由于在整个闭合回路中电子转移数目相等,所以铁电极上产生的氢气气体为0.01mol,在标准状况下为0.224L
本题难度:一般
2、选择题 科学家们在研制一种吸气式的锂—空气电池,工作时吸收空气中的氧气在多孔金制成的正极表面上反应。总反应可表示为2Li+O2 Li2O2,下列有关说法正确的是( )
Li2O2,下列有关说法正确的是( )
A.充电时,多孔金制成的电极外接电源负极
B.放电时,吸收空气中22.4 L的O2,就有2 mol e-从电池负极流出
C.放电时,Li+从负极向正极移动
D.该电池可使用含Li+的水溶液作电解质溶液
参考答案:C
本题解析:多孔金具有很强的吸附性,充电时生成氧气,被多孔金吸附,故氧气应在多孔金处生成,多孔金制成的电极应为阳极,连接电源正极,A项错误;B项没有指出22.4 L O2所处的外界条件,错误;放电时阳离子由负极移向正极,C项正确;Li能与水反应,故不能用水溶液作电池的电解质溶液,D项错误。
本题难度:一般
3、选择题 根据下图所示的装置(甲中电极均为惰性电极),判断下列叙述中正确的是
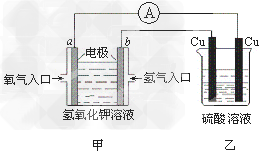
[? ]
A.利用该反应可持续产生硫酸铜直至硫酸耗尽
B.甲中a电极的电极反应为: O2+4H++4e-=2H2O
C.装置开始工作初期乙中的总反应为: Cu+H2SO4 CuSO4+H2↑
CuSO4+H2↑
D.反应过程中甲、乙装置中溶液的pH都逐渐减小
参考答案:C
本题解析:
本题难度:一般
4、填空题 能源是人类生活和社会发展的基础,研究化学反应中的能量变化,有助于更好地利用化学反应为生产和生活服务。阅读下列有关能源的材料,回答有关问题:
(1)从能量的角度看,断开化学键要吸收能量,形成化学键要放出能量。已知拆开1 mol H-H键、1 mol I-I、1 mol H-I键分别需要吸收的能量为436 kJ、151 kJ、299 kJ。则由氢气和碘单质反应(H2+I2=2HI)生成1 mol HI需要 (填“放出”或“吸收”) ___ kJ的热量。
(2)在生产和生活中经常遇到化学能与电能的相互转化。

在如图甲装置中,负极电极反应式为 ,发生的是 反应(填“氧化”或“还原”,下同)。正极电极反应式为 ;总反应的离子方程式为 。
(3)若用氢氧化钾溶液做电解质溶液,用氢气做燃料,空气做氧化剂制成燃料电池,其负极反应式为 ;正极反应式为 。当有标状下2.24L氢气消耗时,另一极消耗氧气的物质的量为 。
(4)在如下图所示的原电池中,铝做 极,导线上电子由 极流向 极。
参考答案:(12分)(1)放出;5.5
(2)Zn—2e—=Zn2+;氧化;2H++2e—=H2↑;Zn+2H+=Zn2++H2↑
(3)2H2—4e—+4OH—=4H2O;O2+4e—+2H2O=4OH—;0.05mol
(4)负;铝;镁(或负;正)
本题解析:(1)反应热就是断键吸收的能量和形成化学键所放出的能量的差值,所以根据键能可知,该反应的反应热=436 kJ/mol+151 kJ/mol-299 kJ/mol×2=-11kJ/mol,所以生成1 mol HI需要放出5.5kJ的热量。
(2)原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则锌是负极,失去电子。铜是正极,溶液中的氢离子在正极得到电子,析出氢气。
(3)氢气在负极通入,由于溶液是碱性溶液,所以负极电极反应式是2H2—4e—+4OH—=4H2O;氧气在正极通入,电极反应式是O2+4e—+2H2O=4OH—;标准状况下2.24L氢气是0.1mol,失去0.2mol电子,所以根据电子的得失守恒可知,需要氧气的物质的量是0.2mol÷4=0.05mol。
(4)镁的金属性强于铝的,但能和氢氧化钠溶液反应的是铝,所以铝是负极,镁是正极,导线上电子由铝电极流向镁电极。
考点:考查反应热的计算、原电池的有关应用、判断和计算
点评:该题是高考中的常见题型,属于中等难度的试题,试题基础性强,贴近高考,旨在培养学生分析、归纳、总结问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般
5、填空题 如图所示装置中,金属镁、铝和电流表通过导线相连:
(1)若烧杯中溶液为稀硫酸,则观察到的现象为______.
两极的电极反应式为:负极______;
正极______.
(2)该反应过程中,反应物总能量______生成物总能量(选填“>”“=”或“<”).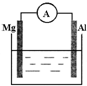
参考答案:(1)镁、铝和稀硫酸构成了原电池,金属镁做负极,电极反应:Mg-2e-=Mg2+,金属铝为正极,溶液中的2H+得到电子发生还原反应,电极反应为:2H++2e-=H2↑,所以可看到镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转故答案为:镁逐渐溶解,铝极上有气泡冒出,电流表指针发生偏转;Mg-2e-=Mg2+;2H++2e-=H2↑.
(2)通过化学反应将化学能转变为电能,反应中产生了电流,应物总能量大于生成物总能量,故答案为:>.
本题解析:
本题难度:一般