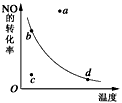
1、选择题 下图中的曲线是表示其他条件一定时,2NO+O2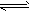 2NO2(该反应放热)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
2NO2(该反应放热)反应中NO的转化率与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是
[? ]
A.a点
B.b点
C.c点
D.d点
参考答案:C
本题解析:
本题难度:一般
2、选择题 下列说法不正确的是( )。
A.原电池负极被氧化
B.任何化学反应都能设计成原电池
C.化学反应的速率和限度均可通过改变化学反应条件而改变
D.化学反应达到平衡状态时,只要条件不改变,各物质的浓度就不再改变
参考答案:B
本题解析:原电池反应的本质是氧化还原反应,因此非氧化还原反应是不能设计成原电池的。
本题难度:简单
3、选择题 对反应:A(g)+3B(g)
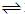
2C(g)的正反应为吸热反应,则为了提高A的转化率,选择的反应条件为( )
A.高温高压
B.高温低压
C.低温高压
D.低温低压
参考答案:A
本题解析:
本题难度:简单
4、选择题 相同温度下,体积均为0. 25 L的两个恒容密闭容器中发生可逆反应:N2(g)+3H2(g) 2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
2NH3(g) ΔH=-92.6 kJ/mol。实验测得起始时的有关数据如表所示:
容器
编号
| 起始时各物质的物质的量/mol
| 达到平衡时体
系能量的变化
|
N2
| H2
| NH3
|
①
| 1
| 3
| 0
| 放出热量:23.15 kJ
|
②
| 0.9
| 2.7
| 0.2
| 放出热量:Q
|
?
下列叙述错误的是( )
A.容器①②中反应的平衡常数相等
B.平衡时,两个容器中NH3的体积分数均为
C.容器②中达到平衡时放出的热量Q=23.15 kJ
D.若容器①体积为0.5 L,则平衡时放出的热量小于23.15 kJ
参考答案:C
本题解析:对于给定反应,平衡常数只是温度的函数,温度相同,平衡常数相同,A正确。由①中放出的热量,可知参加反应的N2为0.25 mol,则有
? N2(g)+3H2(g) 2NH3(g)
2NH3(g)
n(始)/mol 1 3 0
n(变)/mol? 0.25? 0.75? 0.5
n(平)/mol? 0.75? 2.25? 0.5
则①中NH3的体积分数为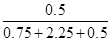 =
= ,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为
,由于①和②中建立的平衡是相同的,所以两容器中NH3的体积分数均为 ,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
,B正确。①和②建立的是相同的平衡,②中N2转化0.15 mol,放出的热量为92.6 kJ/mol×0.15 mol=13.89 kJ,C不正确。若容器①体积为0.5 L,即反应体积增大,压强减小,平衡向逆反应方向移动,则平衡时放出的热量小于23.15 kJ,D正确。
本题难度:一般
5、选择题 对于一个恒容密闭容器中进行的可逆反应:mA(气)+nB(气)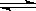 eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是
eC(气)+dD(气) △H<0,下列能证明该反应一定达到平衡状态的是
A.容器内压强不随时间的延长而变化
B.单位时间内每消耗m个A分子的同时也生成了d个D分子
C.单位时间内每生成e个C分子的同时也生成了n个B分子
D.A、B、C、D四种物质的分子数之比为m∶n∶e ∶d
参考答案:C
本题解析:若该反应是一个反应前后气体体积不变的化学反应,无论该反应是否达到平衡状态,容器中气体压强始终不变,故A错误;.单位时间内每消耗m个A分子的同时也生成了d个D分子均指正向反应速率,故B错误;单位时间内每生成e个C分子的同时也生成了n个B分子,既有正向速率又有逆向速率,且符合计量数之比,故C正确;A、B、C、D四种物质的分子数之比为m∶n∶e ∶d不一定达到平衡,故D错误;答案选C.
考点:化学平衡状态的判断依据
本题难度:一般