1、填空题 (1)在一定体积的密闭容器中,进行如下化学反应,CO2(g)+H2(g)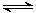 CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
CO(g)+H2O(g)。其化学平衡常数K与温度t的关系如下。请回答下列问题:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
①该反应的化学平衡常数的表达式K = ,由上表数据可得,该反应为 反应。(填“吸热”或“放热”)
②800℃,固定容器的密闭容器中,放入混合物,其始浓度为c(CO)="0.01" mol·L-1、c(H2O)="0.03" mol·L-1、c(CO2)="0.01" mol·L-1、c(H2)="0.05" mol·L-1,则反应开始时,H2O的消耗速率比生成速率 (填"大"、"小" 或"不能确定")
或"不能确定")
③830℃,在1 L的固定容器的密闭容器中放入2 mol CO2和1 mol H2,平衡后CO2的转化率为 。
(2)目前工业上有一种方法是用CO2来生产燃料甲醇。为探究反应原理,现进行如下实验,在体积为1L的密闭容器中,充入1mol CO2和3mol H2,在500℃下发生反应:CO2(g)+3H2(g)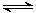 CH3OH(g)+H2O
CH3OH(g)+H2O (g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
(g) △H=-49.0kJ·mol-1。测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:

①平衡时CH3OH的体积分数w为 。
②现在温度、容积相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数 据如下。下列说法正确的是
据如下。下列说法正确的是
容器
| 实验1
| 实验2
| 实验3
|
反应物投入量(始态)
| 1mol CO2、3mol H2
| 1mol CH3OH、1mol H2O
| 2mol CH3OH、2mol H2O
|
CH3OH的平衡浓度/mol·L-1
| C1
| C2
| C3
|
反应的能量变化
| 放出 x kJ
| 吸收y kJ
| 吸收z kJ
|
体系压强/Pa
| P1
| P2
| P3
|
反应物转化率
| a1
| a2
| a3
|
A.2 C1>C3 B.x+y="49.0 " C.2P2< P3
D.(a1+ a3)<1 E.2P1> P3 F.a1= a2
③在一个装有可移动活塞的容器中进行上述反应:CO2(g)+3H2(g)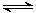 CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
CH3OH(g)+H2O(g)。反应达到平衡后,测得CH3OH的物质的量为a mol,保持容器内的温度和压强不变,向平衡体系中通入少量的H2,再次达到平衡后,测得CH3OH的物质的量为b mol,请比较a、b的大小 。
参考答案:(1)①K=c(CO)×c(H2O)/c(CO2)×c(H2) (1分),吸热(1分);
②小(1分);③CO2的转化率为1/3(1分)
(2)①30%(2分),②BDE(2分)
③a<b(1分)。[解答]为说明问题方便起见,设原浓度皆为1mol?L-1,加入H2时,H2的浓度增大,设为原浓度的x倍(x>1),CO2、CH3OH、H2O的浓度均减小相同倍数,设为原来浓度的y倍(y<1),则Q(浓度商)= y/x3 K(K为平衡常数),所以Q<K,平衡向正反应方向移动,故得a<b。
本题解析:略
本题难度:一般
2、选择题 将等物质的量的F2和ClF混合,在密闭容器中发生反应: F2(g)+ClF(g)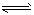 ClF3(g);△H<0。下列叙述中,正确的是
ClF3(g);△H<0。下列叙述中,正确的是
[? ]
A.恒温恒容时,当ClF 转化40% 时,容器内的压强为初始时的0.8 倍
B.若 c(F2):c (ClF): c (ClF3) =1: 1: 1, 则反应一定达到平衡状态
C.达到平衡后,若增大容器体积,则正反应速率减小,逆反应速率增大,平衡左移
D.平衡后再降低温度,保持恒容,达到新的平衡,则混合气体的平均摩尔质量增大
参考答案:AD
本题解析:
本题难度:一般
3、选择题 t℃时,在一密闭容器中充入2molA和3molB,发生如下化学反应:aA(g)+B(g) C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是 ( )
C(g)+D(g) 已知,平衡时,Ca(A)·C(B)= C(C)·C(D),然后在温度不变的情况下,扩大容器容积至原来10倍,结果A的百分含量始终未有改变,则B的转化率是 ( )
A. 60% B. 40% C. 4% D. 无法确定
参考答案:B
本题解析:平衡时,Ca(A)·C(B)= C(C)·C(D),则平衡常数K=1。在温度不变的情况下,扩大容器容积至原来10倍,A的百分含量始终未有改变,这说明反应前后体积是不变的,因此α=1。设B的转化率是x,则生成C、D的物质的量都是3x。平衡时剩余A和B分别是2-3x、3-3x,所以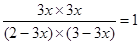 ,解得x=0.4,答案选B。
,解得x=0.4,答案选B。
本题难度:一般
4、填空题 在容积为2.0?L的密闭容器内,物质D在T℃时发生反应,其反应物和生成物的物质的量随时间t的变化关系如图,据图回答下列问题:
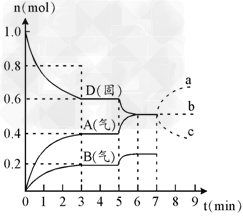
(1)从反应开始到第一次达到平衡时,A物质的平均反应速率为___________mol/L?min。
(2)根据右图写出该反应的化学方程式_________,该反应的平衡常数表达式为K?=?______。
(3)第5分钟时,升高温度,A、B、D的物质的量变化如图,则该反应的正反应是___________(填“放热”或“吸热”)反应,反应的平衡常数____________?(填“增大”、“减小”或“不变”。下同),B的反应速率_________。
(4)若在第7分钟时增加D的物质的量,A的物质的量变化正确的是__________(用图中a、b?、?c的编号回答)
参考答案:(1)?0.067?
(2)2D(s) 2A(g) + B(g);[A]2 ×[B]?
2A(g) + B(g);[A]2 ×[B]?
(3)?吸热?;?增大 ;增大?
(4) b
本题解析:
本题难度:一般
5、选择题 在其他条件不变时,研究改变某一条件对A2(g)+3B2(g) 2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)。据图可得出的判断正确的是
2AB3(g)化学平衡状态的影响,得到如图所示的变化规律(图中T表示温度,n表示物质的量)。据图可得出的判断正确的是

[? ]
A.正反应一定是放热反应
B.达到平衡时A2的转化率大小为a>b>c
C.若T2>T1,则正反应一定是放热反应
D.b点时,平衡体系中A、B原子数之比接近1:3
参考答案:D
本题解析:
本题难度:一般