1、选择题 元素R的质量数为A,Rn-的核外电子数为x,则ngR n-所含中子的物质的量为
A.(A-x+n)mol
B.(A-x-n)mol
C.(A-x+n)n/Amol
D.(A-x-n)n/Amol
参考答案:C
本题解析:略
本题难度:一般
2、填空题 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
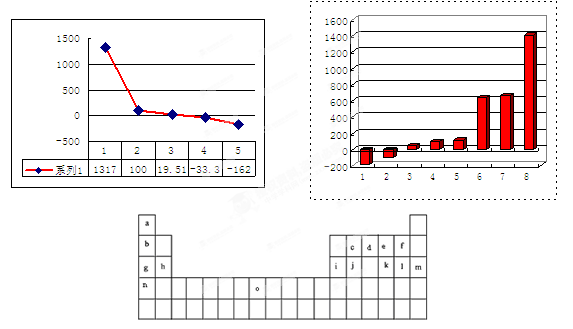
试回答下列问题
(1)元素“O”在周期表中的位置是??。
(2)画出“c”的简化电子排布式?。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表?(填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为:??;序列“1”氢化物的电子式为:?。?
参考答案:(1)第四周期第Ⅷ族; (2)[He]2s22p2(3)m(4)CH4; 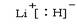
本题解析:(1)根据给出的元素周期表可确定元素“O”在周期表中的位置是第四周期第Ⅷ族。(2)“c”在元素周期表中位于第二周期第ⅣA。该元素是C。的简化电子排布式是[He]2s22p2。(3)第三周期8种元素有Na、Mg、Al、Si、P、S、Cl、Ar。同一周期的元素,从左到右,元素的金属性逐渐减弱,非金属性逐渐增强。元素的金属性越强,其金属单质的熔点就越低。元素的非金属性越强,其单质的熔沸点就越高。其中序列“1”的熔点最低,代表的是Ar。字母代号为m.(4)b、c、d、e、f分别是Li、C、N、O、F。在这些元素形成的氢化物中LiH是离子晶体,其余的都是分子晶体。离子晶体通过离子键结合,断裂较难,所以沸点最高,而在其余的氢化物中,由于HF、H2O、NH3的分子间存在分子间作用力和氢键,所以沸点高于同主族其它元素形成的氢化物的沸点。而CH4则符合一般的规律。即相对分子质量越大,分子间作用力就越大,物质的沸点就越高。由于CH4式量最小,分子间以分子间作用力结合,所以沸点最低。序列“5”氢化物的化学式为:CH4;序列“1”氢化物的LiH,其电子式为: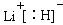 。
。
本题难度:一般
3、填空题 X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
元素
| 相关信息
|
X
| X的基态原子核外的三个能级上电子数相等
|
Y
| Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等
|
Z
| Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体
|
W
| 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色
|
?
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g)?△H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g)?△H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________?。
参考答案:(1)四、 Ⅷ、? 2
(2)正四面体、 离子键?(非极性)共价键
(3)6Na+6H2O+2Fe3+=6Na++3H2↑+2Fe(OH)3↓
(4)ΔH= +421.69kJ/mol.
本题解析:根据题目提供的信息可知:X为C;Y为O;Z为Na;W是Fe。(1)26号元素Fe在元素周期表中位于第四周期第Ⅷ族。基态原子最外层有2个电子。(2)C的最简单氯化物分子CCl4呈正四面体结构。Na在空气中燃烧产生Na2O2. 在离子化合物Na2O2中含有Na、O之间的离子键及O、O之间的非极性共价键。(3)Na投入到FeCl3溶液中时,首先发生反应:2Na+2H2O=2NaOH+H2↑,然后发生:FeCl3+3NaOH=Fe(OH)3↓+3NaCl.总方程式为6Na+6H2O+2FeCl3=6NaCl+3H2↑+2Fe(OH)3↓.离子方程式为:6Na+6H2O+2Fe3+=6Na++3H2↑+2Fe(OH)3↓ 。(①+②×2)÷3整理可得Fe2O3 (s)+CO(g) =" 2" FeO (s)+CO2(g)? ΔH= +421.69kJ/mol.
本题难度:一般
4、选择题 下列叙述中错误的是(?)
A.原子半径:Na>Si>Cl
B.稳定性:SiH4<HCl<H2S
C.金属性:Na>Mg>Al
D.酸性:H3PO4<H2SO4<HClO4
参考答案:B
本题解析:A.同一周期的元素,原子序数越大,原子半径就越小。因此原子半径:Na>Si>Cl。正确。B.同一周期的元素,原子序数越大,元素的非金属性就越强,其对应的氢化物的稳定性就越强,由于原子序数Cl>S>Si,所以氢化物的稳定性:SiH4<H2S<HCl。错误。C.同一周期的元素,原子序数越大,原子半径就越小,原子失去电子就越难,对应的元素的金属性就越弱。因此金属性:Na>Mg>Al。正确。D.同一周期是元素,原子序数越大,元素的非金属性就越强,其最高价氧化物对应的水化物的酸性就越强。元素的非金属性Cl>S>P,所以酸性:H3PO4<H2SO4<HClO4。正确。
本题难度:一般
5、填空题 (1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
参考答案:(1)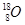 (2)b-n-2 (3)A.< B.> (4)氮
(2)b-n-2 (3)A.< B.> (4)氮
本题解析:(2)中,两种离子aX2-和bYn+具有相同的核外电子排布,说明有下式成立:a+2=b-n,a=b-n-2。
(4)中,由气态氢化物的化学式RH3,可知其最高价氧化物化学式为R2O5。在氧化物中含氧量为 ,可求出元素R的相对原子质量为14,进而确定该元素为氮。
,可求出元素R的相对原子质量为14,进而确定该元素为氮。
本题难度:简单