1、选择题 元素R的质量数为A,Rn-的核外电子数为x,则ngR n-所含中子的物质的量为
A.(A-x+n)mol
B.(A-x-n)mol
C.(A-x+n)n/Amol
D.(A-x-n)n/Amol
2、填空题 下表是元素周期表的一部分。表中所列的字母分别代表某一化学元素。
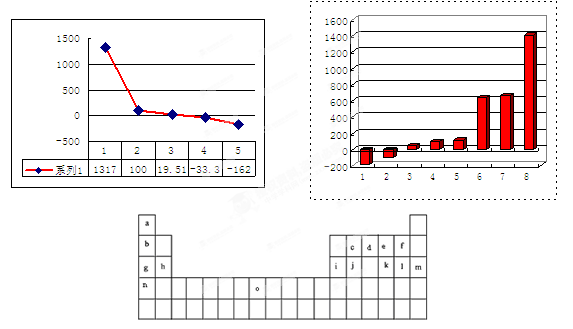
试回答下列问题
(1)元素“O”在周期表中的位置是??。
(2)画出“c”的简化电子排布式?。
(3)第三周期8种元素按单质熔点大小顺序的柱形图如上,其中序列“1”代表?(填字母)。
(4)b、c、d、e、f的氢化物的沸点(℃)直角坐标图如右,序列“5”氢化物的化学式为:??;序列“1”氢化物的电子式为:?。?
3、填空题 X、Y、Z、W是元素周期表前四周期中常见的元素,其相关信息见下表:
元素
| 相关信息
|
X
| X的基态原子核外的三个能级上电子数相等
|
Y
| Y与X同周期,Y基态原子p能级的成对电子数与未成对电子数相等
|
Z
| Z的单质是一种银白色活泼金属,在空气中燃烧后生成淡黄色的固体
|
W
| 向含W2+的溶液中滴加强碱,其白色氢氧化物在空气中迅速变成灰绿色,最后变成红褐色
|
?
(1)W位于周期表的第______周期_____族,其基态原子最外层有________个电子。
(2)X的最简单氯化物分子呈____________型结构, Z在空气中燃烧生成的淡黄色的固体中含有的化学键类型____________________。
(3)若将金属Z投入含WCl3的溶液中,发生反应的离子方程式为____________________。
(4)工业上冶炼W过程涉及以下两个热化学方程式:
3W2Y3(s)+XY(g) =2W3Y4(s)+XY2(g)?△H=-15.73kJ/mol
W3Y4(s)+XY (g) =" 3WY" (s)+XY 2(g)?△H= +640.4kJ/mol
则反应W2Y3 (s)+XY (g) =" 2" WY (s)+XY 2(g) 的△H= _________________?。
4、选择题 下列叙述中错误的是(?)
A.原子半径:Na>Si>Cl
B.稳定性:SiH4<HCl<H2S
C.金属性:Na>Mg>Al
D.酸性:H3PO4<H2SO4<HClO4
5、填空题 (1)写出表示含有8个质子,10个中子的原子的化学符号________;
(2)已知阴离子aX2-和阳离子bYn+具有相同的核外电子排布,则a、b、n之间的关系为a=________;
(3)比较下列大小(填“>”或“<”)
A.原子半径:Cl______Na
B.酸性:H2CO3______H2SiO3
(4)某元素R气态氢化物的化学式为RH3,其最高价氧化物中含氧量为 ,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。
,已知该元素的原子核中中子数和质子数相等,则该元素的名称是________。