1、填空题 下表是元素周期表中短周期元素部分,表 中字 母分别代表一种元素:
上述?元素(填元素名称) 可以形成硬度最大的单质。
⑵“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,并释放出O2,你认为该
物质应该是由上表中的?和?元素(填元素名称)组成的。飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入一种气 体用于稀释氧气,该气体分子是?。(填化学式)
表中元素g的氢化物稳定性比元素e的氢化物的稳定性?(填“强”或“弱”)。
⑷将潮湿的由h元素构成的单质通过甲装置后,再通过放有干燥红色布条的乙装置,红色布条不褪色。则甲装置中所盛试 剂可能是?。(填数字序号)
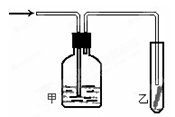
①浓硫酸?②NaOH溶液 ?③KCl溶液?④饱和食盐水
⑸写出h元素构成的单质与水反应的化学方程式:?。
参考答案:⑴碳
⑵?钠?和?氧 ?N2?弱
⑷?①②
⑸Cl2+H2O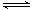 HCl+HClO
HCl+HClO
本题解析:⑴硬度最大的单质为金刚石,其有碳元素构成;⑵“神舟”六号飞船内需要有一种化合物来吸收宇航员呼出的 CO2,并释放出O2,该物质为过氧化钠,故该物质中是由上表中的钠和氧元素组成的;大气中含有大量的氮气,所以飞船中需要制造一种适合宇航员生存的人工生态环境,应该在氧气中充入 一种气 体用于稀释氧气,该气体分子是 N2;表中元素g的氢化物为甲烷,其稳定性比元素e的氢化物硅烷的稳定性强,因为电负性越大,其氢化物越稳定;⑷将潮湿的由h元素构成的单质为氯气,通过甲装置后,红色布条不褪色,说明为氯气被干燥了或者是氯气被吸收了,所以甲瓶中可能盛的试剂可以是浓硫酸或者是氢氧化钠溶液,故本题选择①②;⑸h元素构成的单质与水反应的化学方程式为: Cl2+H2O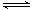 HCl+HClO。
HCl+HClO。
点评:本题考查了元素周期变,元素及其化合物,该考点是高考考查的重点和热点,本题有一定的综合性,该题难度中等。
本题难度:一般
2、选择题 X、 Y、Z、M代表四种金属,有以下化学反应
①?水溶液中:X+Y2+=X2++Y?
②Z+2H2O(冷)=Z(OH)2+H2↑
③Y可以溶于稀硫酸中,M不被稀硫酸氧化,则这四种金属的活动性由弱到强的顺序是(?)
A.M<Y<X<Z
B.M<X<Y<Z
C.M <Y< Z < X
D.X<Z <M<Y
参考答案:A
本题解析:比较金属性强弱可以根据和水或酸反应置换出氢气的难易程度,以及它们之间的相互置换能力等。根据①可得出X>Y,由②可知Z最活泼,根据③可知Y>M。所以正确的答案是A。
本题难度:简单
3、填空题 碳及其化合物应用广泛。
I.工业上利用CO和水蒸汽反应制氢气,存在以下平衡:CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
(1)沸石分子筛中含有硅元素,请写出硅原子结构示意图__________。
(2)向1L恒容密闭容器中注人CO和H2o(g),830℃时测得部分数据如下表。则该温度下反应的平衡常
数K=______________。

(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,此时v(正 ) __________v(逆)(填“>”“=”或“<”)
II.已知CO(g)+1/2 O2 (g)=CO2 (g)?△H=一141 kJ·mol-1
2H2(g)+ O2(g)=2H2O(g)?△H=一484 kJ·mol-1
CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)?△Hl=一726 kJ·mol-1
(4)利用CO、H2化合制得液态甲醇的热化学方程式为___________。
III.一种新型氢氧燃料电池工作原理如下图所示

(5)写出电极A的电极反应式_____________。
(6)以上述电池电解饱和食盐水,若生成0.2mo1 Cl2,则至少需通人O2的体积为_____L(标准状况)。
参考答案:(1) (2分)
(2分)
(2)1 (3分)
(3)< (2分)
(4)CO(g) + 2H2(g)=CH3OH(l)?△H=+101 kJ/mol?(方程式对给1分,共3分)
(5)H2-2e-+ CO32- =CO2 + H2O (3分)?(6)2.24 (2分)
本题解析:(1)硅因素位于第三周期第ⅣA族,因此原子结构示意图为 。
。
(2)根据表中数据可知,平衡时CO和水蒸气的浓度分别是0.080mol/L和0.180mol/L,其中消耗CO的浓度是0.200mol/L-0.080mol/L=0.120mol/L,因此根据方程式可知生成CO2和氢气的浓度均是0.120mol/L,实验该温度下反应的平衡常数K= =1。
=1。
(3)相同条件下,向1L恒容密闭容器中,同时注人1mol CO、1mol H2O(g),2molCO2和2mo1 H2,则此时 =4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
=4>1,所以反应逆反应方向进行,因此v(正 )<v(逆)。
(4)已知① CO(g)+1/2 O2 (g)=CO2 (g)?△H=一141 kJ·mol-1、② 2H2(g)+ O2(g)=2H2O(g)?△H=一484 kJ·mol-1、③ CH3OH(1)+3/2O2 (g)=CO2(g)+2H2O(g)?△Hl=一726 kJ·mol-1,则根据盖斯定律可知①+②-③即得到CO、H2化合制得液态甲醇的热化学方程式为CO(g) + 2H2(g)=CH3OH(l)?△H=+101 kJ/mol。
(5)原电池中负极失去电子,发生氧化反应,正极得到电子发生还原反应。则根据装置图可知,氢气在A电极通入,因此A电极是负极,由于电解质是熔融的碳酸钾,而原电池中阴离子向负极移动,所以负极电极反应式为H2-2e-+ CO32- =CO2 + H2O。
(6)电解池中氯离子放电生成氯气,电极反应式为2Cl-2e-=Cl2↑,所以生成0.2mol氯气转移电子的物质的量是0.4mol。氧气在反应中得到4个电子,因此根据得失电子守恒可知消耗氧气的物质的量是0.4mol÷4=0.1mol,在标准状况下的体积是2.24L。
本题难度:困难
4、选择题 X、Y是短周期元素,它们可组成化合物XY,则下列说法正确的是(? )
A.XY晶体一定是离子晶体
B.若Y的原子序数为m,X的原子序数一定是m±6
C.X、Y可以属于同一周期,也可属于两个不同周期
D.X与Y一定不属于同一主族
参考答案:C
本题解析:A中,化合物XY若为HF,SiC不是离子晶体;B中,若Y是F,X为Na,组成NaF化合物,不合题意,故A、B错误;若X与Y组成SiC、ICl等化合物,均为同一主族,故D错误。
本题难度:简单
5、选择题 下图是第三周期11~17号元素某些性质变化趋势的柱形图,下列有关说法中正确的是

A.y轴表示的可能是第一电离能
B.y轴表示的可能是电负性
C.y轴表示的可能是原子半径
D.y轴表示的可能是形成基态离子转移的电子数
参考答案:B
本题解析:A、同一周期元素随原子序数依次增大,其第一电离能随着原子序数的增大而增大,如第ⅡA元素的第一电离能大于第ⅢA族的,A错误;B、同一周期元素且原子序数依次增大,其电负性随着原子序数的增大而增大,B正确;C、同一周期元素且原子序数依次增大,其原子半径随着原子序数的增大而减小,C错误;D、同一周期元素随原子序数依次增大,金属失电子数增加,非金属得电子数减少;D错误,选B。
本题难度:一般