1、填空题 (18分)金属镍(Ni)的应用越来越广泛。
(1)LiNiO2常用作锂离子电池的正极材料,负极材料是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料。这种锂离子电池的电池反应式为:
xLi+Li1-xNiO2 LiNiO2
LiNiO2
LiNiO2中,Ni元素的化合价为?;充电时,LiNiO2中化合价发生变化的元素有?(填元素符号)
(2)Ni常被镀在金属制品上以保护金属不生锈。镀镍的方法有:
方法Ⅰ:?电镀镍。以NiSO4为电镀液。
① 待镀零件与电源?相连,金属镍板与电源?相连。
方法Ⅱ:化学镀。将待镀零件浸泡在含有Ni2+和H2PO2-的溶液中,在酸性等条件下发生下述反应:
(a)?Ni2+ + ??H2PO2-+ ??→??Ni +? + ??H2PO3-+ ?
(b)6H2PO2- + 2H+= 2P+ 4H2PO3-+ 3H2↑
上述反应可在塑料镀件表面沉积镍—磷合金,从而达到化学镀镍的目的。
② 请在答题卡上写出并配平反应式(a)。
③ 化学镀与电镀相比较,在原理上的相同点是:?。
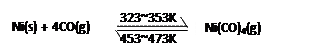 (3)Ni可以与CO(g)发生反应:
(3)Ni可以与CO(g)发生反应:
利用该反应可以提纯粗Ni,得到高纯度的金属Ni。
① 该反应的平衡常数表达式为?
② 生产中,在如图所示密闭容器中充入CO气体,粗Ni放置在?(填编号)
 A.低温区? B.高温区
A.低温区? B.高温区
参考答案:
(1)+3,Li、Ni?(4分)?(2)①负极,正极?(4分)
②2Ni2+ + 1H2PO2-+ 1H2O → 2 Ni+? +1H2PO3-+ 2 H+(4分)
③都利用氧化还原反应?(2分)?(3)① ?(2分)? ②A (2分)
本题解析:略
本题难度:简单
2、选择题 下列四种装置中,溶液的体积均为250 mL,开始时电解质溶液的浓度均为0.10 mol·L-1,工作一段时间后,测得导线上均通过0.02 mole-,若不考虑溶液体积的变化,则下列叙述正确的是
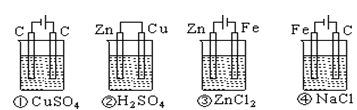
A.工作一段时间后溶液的浓度①=②=③=④
B.工作一段时间后溶液的pH值:④>③>①>②
C.产生气体的总体积:④>③>①>②
D.电极上析出的固体的质量:①>②>③>④
参考答案:B
本题解析:①③④是电解池②原电池,①是电解硫酸铜溶液,溶液中的氢氧根离子失去电子产生氧气,溶液中的铜离子得到电子在阴极析出铜单质,溶液最后呈碱性;②是原电池锌做负极失去电子溶液中的氢离子在正极得到电子变为氢气,最后的溶液呈酸性③是电解池锌在阳极失去电子,溶液中的氢离子在阴极得到电子,最后溶液呈碱性④是电解饱和食盐水,氯离子在阳极失去电子产生氯气,溶液中的氢离子在阴极得到电子产生氢气,最后溶液呈碱性,所以A错误,产生气体的总体积的大小关系为④>①=②=③,C错误;只有①中电极上有固体析出,其它电极上没有固体析出,所以D错误;溶液的PH大小关系为④>③>①>②。
本题难度:一般
3、填空题 电解原理在化学工业中有广泛应用。右图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连。请回答
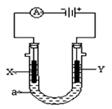
(1)若X、Y都是惰性电极,a是饱和NaCl溶液,实验开始时,同时在两边各滴入几滴酚酞试液,则
①电解池中X极上的电极反应式为 。在X极附近观察到的实验现象是 。
②Y电极上的电极反应式为 。检验该电极反应产物的方法是 。
(2)如要用电解方法精炼粗铜,电解液a选用CuSO4溶液,则
①X电极的材料是 ,电极反应为 。
②Y电极的材料是 ,电极反应式为 。
(说明:杂质发生的电极反应不必写出)
参考答案:(1)①2H++2e-=H2↑ 放出气体,溶液变红
②2Cl—2e-=Cl2↑ 把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)①纯铜 Cu2++2e-=Cu ②粗铜 Cu—2e-=Cu2+
本题解析:(1)①X电极与电源的负极相连,做阴极,溶液中的氢离子放电,电极反应式是2H++2e-=H2↑。由于溶液中氢离子放电,破坏力阴极周围水的电离平衡,导致溶液中OH-浓度增大,溶液碱性增强,即在X极附近观察到的实验现象是放出气体,溶液变红。
②Y电极是阳极,溶液中的氯离子放电,电极反应式是2Cl—2e-=Cl2↑。氯气具有强氧化性,据此可以进行检验,具体方法是把湿润的碘化钾淀粉试纸放在Y电极附近,试纸变蓝色。
(2)粗铜精炼时,粗铜做阳极和电源的正极相连,发生氧化反应。纯铜做阴极,和电源的负极相连,溶液中的铜离子放电,发生还原反应。
考点:考查电解饱和食盐水以及纯铜精炼的有关判断和电极反应式的书写
点评:该题是高考中额常见题型和重要的考点,属于基础性试题的考查,难度不大。该题的关键是明确电解原理,以及溶液中离子的放电顺序,有助于培养学生的应试能力和规范的答题能力,提高学生灵活运用基础知识解决实际问题的能力。
本题难度:一般
4、选择题 早在1807年化学家戴维用电解熔融氢氧化钠制得钠 4NaOH(熔)?
?4Na+O2↑+2H2O;后来盖?吕萨克用铁与熔融氢氧化钠作用也制得钠,反应原理为:3Fe+4NaOH??Fe3O4+2H2↑十4Na↑.下列有关说法正确的是( )
A.电解熔融氢氧化钠制钠,阳极发生电极反应为:2OH--2e-=H2↑+O2↑
B.盖?吕萨克法制钠原理是利用铁的还原性比钠强
C.若戴维法与盖?吕萨克法制得等量的钠,则两反应中转移的电子总数也相同
D.目前工业上常用电解熔融氯化钠法制钠(如图),电解槽中石墨极为阳极,铁为阴极
