1、选择题 实验是研究化学的基础,下图中所示的实验方法、装置或操作完全正确的是
[? ]
A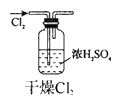
B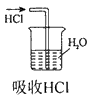
C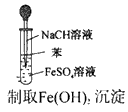
D
2、实验题 无水硫酸铜在强热下会发生分解反应:
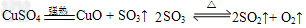
用下图所示装置(夹持仪器已略去),根据D管在反应前后的质量差计算出分解了的无水硫酸铜的质量。
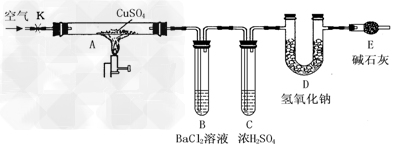
实验步骤:
①称量反应前D管的质量。
②连接好装置,关闭K,加热硬质玻璃管A一段时间后,停止加热。
③待硬质玻璃管A冷却后,打开K,通入一段时间的已除去二氧化碳等酸性气体的空气。
④再称量D管,得其反应前后的质量差为m。
回答下列问题:
(1)2SO3(g) 2SO2(g)?+?O2(g)?该反应的平衡常数表达式为K=____________。
2SO2(g)?+?O2(g)?该反应的平衡常数表达式为K=____________。
(2)B管中除温度明显升高外,还可看到的现象是________________________,而温度明显升高的主要原因是_____________;B管中发生反应的有关离子方程式是_______________。
(3)步骤③中通一段时间已除去二氧化碳等酸性气体的空气的目的是?____________。
(4)按上述方法实验,假设B、C、D对气体的吸收均完全,并忽略空气中CO2的影响,能否根据m计算出分解了的无水CuSO4的质量?(任选其一回答)
①如果能,则分解的无水CuSO4的质量为_____________(用m表示)。
②如果不能,则原因是_______________。为了能测得分解了的无水硫酸铜的质量,你的简单实验方案是__________________。
3、选择题 除去粗盐溶液中的Ca2+、Mg2+、SO42-等杂质,需依次加入稍过量的NaOH溶液、X溶液、Y溶液,最终滴加稀盐酸调至中性.其中X、Y分别是( )
A.Na2CO3,Ba(NO3)2
B.Na2CO3,AgNO3
C.Na2CO3,BaCl2
D.BaCl2,Na2CO3
4、简答题 现有一包固体粉末,其中可能含有CaCO3、Na2CO3、Na2SO4、NaCl、CaCl2、CuSO4.进行如下实验:①溶于水得无色溶液;②向溶液中加BaCl2溶液生成白色沉淀,再加盐酸时沉淀消失.据上述实验现象推断:
(1)由实验①可以得出的结论是______;
(2)由实验②可以得出的结论是______;可能存在的物质是______;
(3)对于可能存在的物质应如何进一步检验?写出简要步骤、现象和结论.______.
(4)写出实验②所涉及的离子方程式.______.
5、填空题 根据所学知识回答下列问题:
(1)下列仪器中:①燃烧匙 ②容量瓶 ③蒸馏烧瓶 ④天平 ⑤分液漏斗 ⑥滴定管
常用于物质分离的是___________(填序号) 。
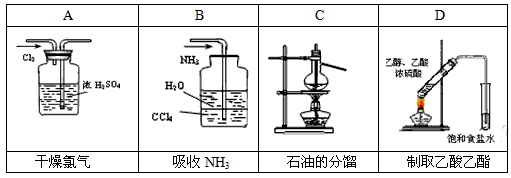
(2)用下列实验装置完成对应的实验(部分仪器略去),能达到实验目的的是________(填字母)。
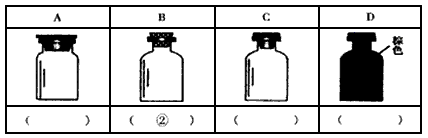
(3)下图是常见的试剂瓶。请将下列试剂的序号填写在相应试剂瓶的括号内:
①大理石 ②碳酸钠溶液 ③浓硫酸 ④氯水 ⑤酒精 ⑥浓硝酸