| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学知识点总结《反应速率与平衡的有关计算》在线测试(2017年最新版)(十)
 ①当合成氨反应达到平衡后,改变某一外界条件(不改变N2、H2和NH3的量),反应速率与时间的关系如下图所示。 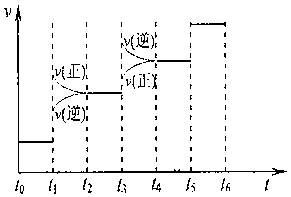 ? ?图t1时引起平衡移动的条件可能是?。 其中表示平衡混合物中NH3含量最高的一段时间是?。 ②温度为T°C时,将3amolH2和amolN2放入带有活塞的密闭容器中,如果活塞能自由移动,充分反应后测得N2的转化率为50%。如果在相同温度下将3amolH2、amolN2和2amolNH3气体放入该容器中,平衡时H2的转化率为?。 参考答案:(12分)(1)保护臭氧层 本题解析:略 本题难度:简单 5、计算题 (12分)氯化硫酰(SO2Cl2)主要用作氯化剂。它是一种无色液体,熔点—54.1℃,沸点69.1℃,遇水生成硫酸和氯化氢。氯化硫酰可用干燥的二氧化硫和氯气在活性炭催化剂存在下反应制取:SO2(g)+Cl2(g) |
参考答案:⑴AC? ⑵0.0706? (3分)? (3) 1.25×10-6 (3分)
⑷SO2Cl2+2H2O=H2SO4+2HCl? SO2+Cl2+2H2O=H2SO4+2HCl? H2SO4+BaCl2=BaSO4?↓+2HCl
由S元素质量守恒,可得:BaSO4的物质的量为0.12mol
质量为:0.12mol×233g/mol=27.96g? (4分)
本题解析:(1)缩小容器体积,则气体浓度增大,即压强增大,平衡正向移动,能提高Cl2的平衡转化率;使用催化剂,不影响平衡移动,则不能提高Cl2的平衡转化率;增加SO2浓度,平衡正向移动,能提高Cl2的平衡转化率;升高温度,平衡逆向移动,Cl2的平衡转化率减小;
(2)?SO2(g)+Cl2(g) SO2Cl2(l)
SO2Cl2(l)
C(初始)? 0? 0? 0.12
△C? 0.119? 0.119? 0.119
C(平衡) 0.119? 0.119? 0.001
平衡常数K=0.001mol.L-1/(0.119 mol.L-1×0.119 mol.L-1)= 0.0706(mol.L-1)-1;
(3)? AgCl(S) ?Ag+(aq)+Cl-(aq)?
?Ag+(aq)+Cl-(aq)?
Ksp(AgCl)=2.0×10-10=[Ag+][Cl-],则[Cl-]=2.0×10-9 mol.L-1
Ag2SO4(S)  ?2Ag+(aq)+SO42-( aq)
?2Ag+(aq)+SO42-( aq)
Ksp(Ag2SO4)=1.6×10-5=[Ag+]2[SO42-] ,则[SO42-]= 1.6×10-3mol.L-1
故[Cl-]:[SO42-]=1.25×10-6
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点归纳《酯》答题技.. | |