| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学平衡》考点预测(2017年强化版)(八)
参考答案:B 本题解析:根据质量守恒定律可知反应后气体的总质量是28ag+2bg,所以氨气的质量分数为 本题难度:一般 2、填空题 (6分)在2 L容器中有3种物质进行反应,X、Y、Z的物质的量随时间的变化曲线如图所示,反应在t时刻达到平衡(X、Y、Z均为气态)。 |
参考答案:(1)(2分)2X 3Y+Z(写“ = ”扣1分)
3Y+Z(写“ = ”扣1分)
(2)(2分)0.6/t mol·(L·min)-1 (不写单位或写错扣1分)
(3)(2分)BC(对1个得1分,多答或错答0分)
本题解析:(1)根据图像可知X的物质的量减少,Y、Z的物质的量增加,所以X是反应物,Y、Z是生成物。到达平衡时X、Y、Z的变化量分别为2.4mol-1.6mol=0.8mol、1.2mol、0.4mol,所以变化量之比是2
本题难度:一般
3、选择题 某温度下,体积一定的密闭容器中进行反应:N2(g)+3H2(g)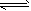 2NH3(g) △H<0。下列分析正确的是
2NH3(g) △H<0。下列分析正确的是
[? ]
A.平衡后加入N2,该反应的△H增大
B.若平衡后升高温度,则平衡常数K变大
C.平衡后再充入NH3,达到新平衡时,NH3的百分含量变大
D.若反应前充入的N2与H2物质的量相等,达平衡时N2的转化率比H2的高
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知:2SO2(g) + O2(g)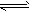 2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为
2SO3(g) △H = -196.6 kJ/mol 。现有SO2和O2各2mol,在恒温下的固定体积容器中反应,平衡时SO2的转化率为a,而在绝热密闭的同一反应容器中反应,平衡时SO2的转化率为b,则a与b的正确关系为
[? ]
A.a > b
B.a = b
C.a < b
D.无法判断
参考答案:A
本题解析:
本题难度:一般
5、选择题 如图所示,对于反应:X(g)+Y(g)═2Z(g);△H<0,如果反应开始经t1秒后达平衡,又经t2秒后,由于条件改变,原平衡破坏,到t3秒时又建立新的平衡,则t2到t3曲线变化的原因是( )
A.增大了X或Y的浓度
B.使用了催化剂
C.增大了体系压强
D.升高了该反应的温度
参考答案:A、t2到t3X或Y的浓度增大,Z的浓度减小,若增大了X或Y的浓度,平衡向正反应方向移动,Z的浓度应增大,不符合,故A错误;
B、使用了催化剂,平衡不移动,X、Y、Z的浓度应不变,故B错误;
C、增大了体系压强,平衡不移动,X、Y、Z的浓度应增大,故C错误;
D、该反应放热,升高该反应的温度,平衡逆向移动,X或Y的浓度增大,Z的浓度减小,图象符合,故D正确.
故选D.
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高中化学知识点大全《热化学方程.. | |