1、计算题 (10分)某化学反应2A(g)  B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度(
B(g) + D(g)在四种不同条件下进行,反应器均为相同恒容密闭容器,B、D起始浓度为0。反应物A的浓度( )随反应时间(min)的变化情况如下表:
)随反应时间(min)的变化情况如下表:
实验
序号
|
| 0
| 10
| 20
| 30
| 40
| 50
| 60
|
1
| 800℃
| 1.0
| 0.80
| 0.67
| 0.57
| 0.50
| 0.50
| 0.50
|
2
| 800℃
| C2
| 0.60
| 0.50
| 0.50
| 0.50
| 0.50
| 0.50
|
3
| 800℃
| C3
| 0.92
| 0.75
| 0.63
| 0.60
| 0.60
| 0.60
|
4
| 820℃
| 1.0
| 0.40
| 0.25
| 0.20
| 0.20
| 0.20
| 0.20
|
根据上述数据,完成下列填空:
(1)在实验1中,反应在10~20分钟内用A表示的平均速率为 ____________ 。
(2)在实验2中,A的初始浓度C2=  ,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
,反应经20分钟就达到平衡,可推测实验2中还隐含的条件是 。
(3)设实验3的反应速率为υ3,实验1的反应速率为υ1,则υ3 υ1(填>、=、<),且C3=  。
。
(4)由上述实验,可推测该反应是 反应(选填“吸热”或“放热”)。理由是:
。
(5)1~4组实验中,A的平衡转化率最大的是第 组。
(6)在实验2中,50 min后,若将容器体积增大1倍,则达平衡时B的浓度为 _____  ;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
;该反应的平衡常数K (填“不变”或“增大”或“减小”)。
参考答案:(1)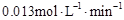 (1分) (2)1.0 (1分)使用了催化剂(1分)
(1分) (2)1.0 (1分)使用了催化剂(1分)
(3)>(1分) C3= (1分)(提示:利用相同温度下平衡常数不变进行计算。)
(1分)(提示:利用相同温度下平衡常数不变进行计算。)
(4)吸热(1分) 实验4和1比较,温度升高,A的平衡浓度减小,平衡向正反应方向移动,则正反应是吸热反应(1分)
(5)4(1分) (6) (1分);不变(1分)。
(1分);不变(1分)。
本题解析:(1)在实验1中,反应在10~20分钟内A的浓度减少了0.80mol/L-0.67mol/L=0.13mol/L,所以反应速率是0.13mol/L÷10min=0.013mol/(L·min)。
(2)在实验2中,平衡状态和实验1相同,所以A的起始浓度是1.0mol/L.但达到平衡的时间少,说明反应速率快,因此使用了催化剂。
(3)在实验1、3中,反应在10~20分钟内A的浓度分别减少了0.13mol/L和0.17mol/L,所以υ3>υ1。由于温度不变,所以平衡常数不变,即
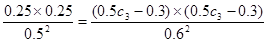 ,解得C3=1.20mol/L。
,解得C3=1.20mol/L。
(4)实验4和1比较,温度升高,A的平衡浓度减小,说明平衡向正反应方向移动,所以正反应是吸热反应。
(5)在实验4中A的平衡浓度最小,说明转化率最大,所以答案选实验4。
(6)实验2中B的平衡浓度是0.25mol/L,由于反应前后体积不变,所以改变压强平衡不移动,因此B的浓度变为0.125mol/L。平衡常数与温度有关系,所以不变。
本题难度:一般
2、简答题 CO和H2可作为能源和化工原料,应用十分广泛.
已知(Ⅰ)CO(g)+2H2(g)=CH3OH(g)△H1=-90.1kJ?mol-1
(Ⅱ)CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H2=-49.0kJ?mol-1
(Ⅲ)CO(g)+H2O(g)=CO2(g)+H2(g)△H3=-41.1kJ?mol-1
(Ⅳ)2CH3OH(g)=CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
回答下列问题:
(1)写出由H2和CO直接制备二甲醚的热化学方程式为______.根据化学反应原理,分析增加压强对直接制备二甲醚反应的影响______.
(2)有研究者在催化剂(含Cu-Zn-Al-O和Al2O3)、压强为5.0MPa的条件下,由H2和CO直接制备二甲醚,结果如图甲所示.其中CO转化率随温度升高而降低的原因是______.
(3)由CO和H2在催化剂作用下,也可以合成甲醇.反应原理为:CO(g)+2H2(g)?CH3OH(g).
①对于气相反应,用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)也可以平衡常数(记作KP),则以上反应KP=______;
②在容积均为1L的密闭容器(a、b、c、d、e)中,分别充入1molCO和2molH2等量混合气体,在不同的温度下(温度分别为T1、T2、T3、T4、T5),经相同的时间,在t时刻,测得容器甲醇的体积分数(如图乙所示).解析在T1~T2及T4~T5二个温度区间,容器内甲醇的体积分数如图乙所示的变化趋势,其原因是______.
③在不改变反应物用量情况下,将容器c中的平衡状态转变到容器d中的平衡状态,可采取的措施有(写出2点)______、______.
参考答案:(1)Ⅰ、CO(g)+2H2(g)═CH3OH(g)△H1=-90.1kJ?mol-1
Ⅳ、2CH3OH(g)═CH3OCH3(g)+H2O(g)△H4=-24.5kJ?mol-1
依据盖斯定律Ⅰ×2+Ⅳ得到:2CO(g)+4H2(g)=CH3OCH3+H2O(g),△H=-204.7kJ?mol-1;
该反应是气体体积减小的反应,增加压强,平衡正向进行,反应速率加快,CO和H2的转化率增大,CH3OCH3产率增加,
故答案为:2CO(g)+4H2(g)=CH3OCH3(g)+H2O(g),△H=-204.7kJ?mol-1;增大压强,化学反应速率增大,平衡正向移动,CO和H2转化率增大,CH3OCH3产率增加;
(2)CO转化率随温度升高而降低,是因为反应是放热反应,升温平衡逆向进行,故答案为:反应放热,温度升高,平衡逆向移动;
(3)①平衡常数指的是:生成物浓度之幂或分压力的乘积与反应物浓度的幂或分压力的乘积之间的比值,故KP=c(CH3OH)c(CO)c2(H2),
故答案为:c(CH3OH)c(CO)c2(H2);
②反应进行到t时刻时,a、b没有达到平衡状态,c、d、e达到平衡状态,故T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少,
故答案为:T1-T2区间,化学反应未达到平衡状态,温度越高,化学反应速率越快,所以甲醇的体积分数随着温度的升高而提高.T3-T4区间,化学反应已达到平衡状态,由于正反应为放热反应,温度升高平衡向逆反应方向移动,所以甲醇的体积分数减少;
③将容器c中的平衡状态转变到容器d中的平衡状态,即降低甲醇的含量,使平衡逆向移动,可采取的措施有:升温、减压,
故答案为:升温;降压.
本题解析:
本题难度:一般
3、选择题 反应2A(g) 2B(g)+C(g) △H>0,达平衡时,要使c(A)增大、v(正)增大,应采取的措施是
2B(g)+C(g) △H>0,达平衡时,要使c(A)增大、v(正)增大,应采取的措施是
[? ]
A. 降温
B. 加催化剂
C. 升温
D. 加压
参考答案:D
本题解析:
本题难度:一般
4、填空题 (10分)偏二甲肼与N2O4是常用的火箭推进剂,二者发生如下化学反应:
(CH3)2NNH2(l)+2N2O4(l) 2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
2CO2(g)+3N2(g)+4H2O(g) (Ⅰ)
(1)反应(Ⅰ)中氧化剂是 。
(2)火箭残骸中常现红棕色气体,原因为:N2O4(g) 2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
2NO2(g) (Ⅱ)当温度升高时,气体颜色变深,则反应(Ⅱ)为 (填“吸热”或“放热”)反应。
(3)一定温度下,反应(Ⅱ)的焓变为ΔH。现将1 mol N2O4充入一恒压密闭容器中,下列示意图正确且能说明反应达到平衡状态的是 。

若在相同温度下,上述反应改在体积为1 L的恒容密闭容器中进行,平衡常数 (填“增大”、“不变”或“减小”),反应3 s后NO2的物质的量为0.6 mol,则0 s~3 s内的平均反应速率v(N2O4)= mol·L-1·s-1。
参考答案:(1)(1)N2O4 (2)吸热 (3)a、d 不变 0.1
本题解析:(1)分析元素的化合价可知,氮元素的化合价由N2O4中的+4价,变成了生成物N2中的0价,故可知N2O4为氧化剂;(2)由温度升高时,红棕色加深,说明升温平衡向生成NO2的方向移动,即该反应的正反应为吸热反应;(3)作为化学平衡状态的标志,须由原来的“变量”变到“不变量”,方可说明,在恒压条件下,随着反应的进行生成NO2,气体的总的物质的量不断增加,容器的体积增大,故密度变小,当密度不变时,可说明化学反应达到平衡状态,a正确;b图,作为反应热,ΔH只与这个化学方程式有关,是一个不变量,它不会随着反应“量”的变化而变化,b错误;c图,用化学反应速率判断可逆反应是否达到平衡状态时,一定是“异向”,且它们的反应速率之比等于化学计量数之比,故c错误。d图,当NO2的转化率不变时,说明v(正)=v(逆),反应达到了平衡状态,d正确。平衡常数是温度的函数,只受温度的影响,故温度不变,化学平衡常数不变。由题意可知,NO2的化学反应速率,v(NO2)=0.2 mol·L-1·s-1,由化学反应速率之比等于化学计量数之比,得出v(N2O4)=0.1 mol·L-1·s-1,答案为a、d 不变 0.1。
考点:考查化学反应速率的计算,化学平衡状态的判断,反应热,氧化还原反应等知识。
本题难度:一般
5、选择题 相同容积的四个密闭容器中进行同样的可逆反应:
2A(g)+B(g) 3C(g)+2D(g)
3C(g)+2D(g)
起始时四个容器所盛A、B的物质的量分别为
在相同温度下建立平衡时,A或B的转化率大小关系正确的是(?)。
A.αA:甲<丙<乙<丁? B.αA:甲<乙<丙<丁
C.αB:甲<丙<乙<丁? D.αB:丁<乙<丙<甲
参考答案:AD
本题解析:甲和乙相比,甲相当于在乙的基础之上增加1mol 的A,则αA:甲<乙,αB:乙<甲;同理,丁和乙相比,丁相当于在乙的基础之上增加1mol 的B,则αA:乙<丁,αB:乙>丁;丙和乙相比,丙相当于在乙的基础之上增加压强,则αA:丙<乙,αB:乙<丙;甲和丙相比,丙相当于在甲的基础之上增加1mol 的B,则αA:甲<丙,αB:丙<甲;综上所述,αA:甲<丙<乙<丁;αB:丁<乙<丙<甲
本题难度:一般