|
高考化学知识点总结《未知》试题强化练习(2017年最新版)(一)
2017-11-11 03:32:47
来源:91考试网
作者:www.91exam.org 【 大 中 小】
|
1、填空题 (1)(8分)某反应体系中的物质有NaOH、Au2O3,Na2S4O6,Au2O,H2O,Na2S2O3。Au2O3为反应物,回答下列部题
A.NaOH是(反应物、生成物)
B.Na2S4O6是(氧化剂、还原剂、氧化产物、还原产物)
C.氧化剂和还原剂的物质的量之比是
D.0.25mol Au2O3发生反应,转移电子数是
| (2)(3分)在酸性条件下MnO4-将SO2氧化成SO42-的同时被还原成Mn2+.写出反应的离子方程式并配平:?
2、填空题 (10分)工业上用MnO2和KOH为原料制取高锰酸钾,主要生产过程分两步进行。第一步将MnO2和固体KOH粉碎,混合均匀,在空气中加热至熔化,并连续搅拌,制取K2MnO4;第二步将K2MnO4的浓溶液进行电解,制取KMnO4。试回答以下问题:
(1)制取K2MnO4的MnO2是这一氧化还原反应的_____________剂(填“氧化”或“还原”),连续搅拌的目的是________________________________。
(2)电解K2MnO4的浓溶液时,两极发生的电极反应式为:
阴极是_______________________,
阳极是_________________________,
电解总的反应方程式是_________________________。
3、选择题 用CH4催化还原NOx可以消除氮氧化物的污染。例如:
①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)? ΔH=-574kJ·mol—1
②CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)? ΔH=-1160kJ·mol—1
下列说法不正确的是:
A.由反应①可推知:CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(l) ΔH=-Q,Q>574kJ·mol—1
B.等物质的量的甲烷分别参加反应①、②,反应转移的电子数不同
C.若用标准状况下4.48L CH4还原NO2至N2,放出的热量为173.4kJ
D.若用标准状况下4.48L CH4还原NO2至N2,整个过程中转移的电子总物质的量为1.6mol
4、填空题 (8分)
(1)硫酸铵在强热条件下分解,生成氨、二氧化硫、氮气和水,其
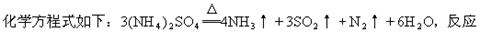
成的氧化产物与还原产物分子个数之比为_______________。
(2)某钠盐A的溶液,实验时有以下一现象:(1)加入Ba(NO3)2溶液时出现白色沉淀,(2)加入Na2CO3,有气泡产生,由此可判断出该钠盐A为___________(化学式),写出有关离子方程式_____________________________,____________________________________。
5、选择题 PbO2受热分解为+4和+2价的Pb的混合氧化物, +4价的Pb能氧化浓盐酸生成Cl2 ,现将1molPbO2加热分解得到O2 ,再向残余固体中加入过量的浓盐酸得到Cl2 , O2和Cl2物质的量之比为3:2,则残余固体的组成及物质的量之比可能是
A.2:1混合的Pb3O4、PbO
B.1:4:1混合的PbO2、Pb3O4、PbO
C.1:2混合的PbO2、Pb3O4
D.1:1:4混合的PbO2、Pb3O4、PbO
|