1、填空题 配平下列离子方程式,并用双线桥法表示电子转移的关系:
MnO4-+SO32-+H+-------Mn2++SO42-+H2O
参考答案: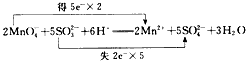
本题解析:
本题难度:一般
2、选择题 a mol FeS与b mol FeO投入到VL、c mol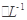 的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(? )
的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看作是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为(? )
①(a+b)x63g?②(a+b)x189g?③(a+b)mol?④(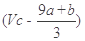 )mol
)mol
A.①④
B.②③
C.①③
D.②④
参考答案:D
本题解析:第一种情况:硝酸有剩余。由电子守恒知:a mol FeS与b mol FeO:→Fe(NO3)3和H2SO4,共转移的电子的物质的量 (9a+b) mol,所以被还原的硝酸是(9a+b)/3 mol,则未被还原的硝酸为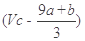 ?mol;第二种情况:硝酸恰好完全反应生成NO和Fe(NO3)3,则未被还原的硝酸的物质的量是3(a+b) mol,质量(a+b)x189g。所以D正确。
?mol;第二种情况:硝酸恰好完全反应生成NO和Fe(NO3)3,则未被还原的硝酸的物质的量是3(a+b) mol,质量(a+b)x189g。所以D正确。
本题难度:一般
3、选择题 2011年4月10日,我国在西昌卫星发射中心用“长征三号甲”运载火箭,成功将第八颗北斗导航卫星送入太空预定转移轨道。该火箭所用燃料是偏二甲肼(CH3-NH-NH-CH3)和四氧化二氮(N2O4)。在火箭升空过程中,燃料发生反应:CH3-NH-NH-CH3+2N2O4→2CO2+3N2+4H2O,提供能量。下列有关叙述正确的是(?)

A.该反应中N2O4是氧化剂,偏二甲肼是还原剂
B.N2是氧化产物,CO2是还原产物
C.CO2是氧化产物,N2是还原产物
D.每有0.6molN2生成,转移电子数目为2.4NA
参考答案:A
本题解析:偏二甲肼(CH3-NH-NH-CH3)中C为-2价,N也是-2价,四氧化二氮(N2O4)中N是+4价,二氧化碳中C是+4价,根据化合价的变化,可判断出,偏二甲肼被氧化为氮气和二氧化碳,四氧化二氮被还原为氮气。所以偏二甲肼是还原剂,N2O4是氧化剂。氮气既是氧化产物也是还原产物,二氧化碳是氧化产物。所以B,C不对。反应中2molN2O4得16mol电子,生成3molN2,所以生成0.6molN2,转移电子数目为3.2NA
本题难度:一般
4、选择题 爆竹的主要成分为硫黄、炭粉和硝酸钾,为了一些特殊效果还加入镁粉、铁粉、铝粉、锑粉及无机盐。下列说法中不正确的是( )
A.爆竹爆炸不宜使用水来灭火,可用干沙
B.爆竹的燃放产生大量污染气体,应加以限制
C.爆竹燃放过程中硝酸钾作氧化剂
D.爆竹爆炸过程中发生反应为2KNO3+3C+S K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)
K2S+N2↑+3CO2↑,每生成1 mol N2转移10NA个电子(NA表示阿伏加德罗常数的值)
参考答案:D
本题解析:化合价降低的元素有N、S,化合价升高的元素只有C,生成1 mol N2,消耗3 mol C,转移电子数3 mol×4="12" mol,D选项错误
本题难度:一般
5、填空题 (15分)硫酸厂用煅烧黄铁矿(FeS2)来制取硫酸,实验室利用硫酸厂烧渣(主要成分是Fe2O3及少量FeS、SiO2)制备绿矾.
⑴SO2和O2反应制取SO3的反应原理为:2SO2+O2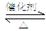 2SO3,在一密闭容器中一定时间内达到平衡.
2SO3,在一密闭容器中一定时间内达到平衡.
①该反应的平衡常数表达式为: .
②该反应达到平衡状态的标志是 .
A.v(SO2)=v(SO3) B.混合物的平均相对分子质量不变
C.混合气体质量不变 D.各组分的体积分数不变
⑵某科研单位利用原电池原理,用SO2和O2来制备硫酸,装置如图,电极为多孔的材料能吸附气体,同时也能使气体与电解质溶液充分接触.

①B电极的电极反应式为 ;
②溶液中H+的移动方向由 极到 极;(用A、B表示)
⑶测定绿矾产品中含量的实验步骤:
a.称取5.7 g产品,溶解,配成250 mL溶液
b.量取25 mL待测液于锥形瓶中
c.用硫酸酸化的0.01 mol/L KMnO4溶液滴定至终点,消耗KMnO4溶液体积40 mL
根据上述步骤回答下列问题:
①滴定时发生反应的离子方程式为(完成并配平离子反应方程式).
Fe2++ 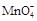 + —— Fe3++ Mn2++
+ —— Fe3++ Mn2++
②用硫酸酸化的KMnO4滴定终点的标志是 .
③计算上述产品中FeSO4·7H2O的质量分数为 .
参考答案:⑴① ②BD
②BD
⑵①SO2+2H2O-2e-==SO42-+4H+ ②B A
⑶①5Fe2++1 +8H+===5Fe3++1Mn2++4H2O
+8H+===5Fe3++1Mn2++4H2O
②滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色。 ③0.975或97.5%
本题解析:(1)①根据平衡常数的概念可知 。
。
②A项没有正逆反应速率,不能判断;B项混合物的平均相对分子质量反应前后不同,可以判断;C项混合气体的质量反应前后不变,不能判断;D项各组分的体积分数反应前后不同,可以判断。答案选BD。
(2)①根据B极的产物可以看出B极发生氧化反应,是负极,电极方程式为SO2+2H2O-2e-=SO42-+4H+。
②阳离子向正极移动,所以H+从B极向A极移动。
(3)①根据化合价升降法,方程式配平为5Fe2++1 +8H+===5Fe3++1Mn2++4H2O。
+8H+===5Fe3++1Mn2++4H2O。
②KMnO4本身有颜色,所以不需要指示剂,用本身的颜色就可以判断终点,当滴定最后一滴酸性KMnO4时溶液呈淡紫色,半分钟内不褪色时达到滴定终点。
③产品中FeSO4·7H2O的质量分数为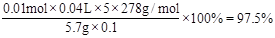 。
。
考点:化学平衡、原电池和氧化还原滴定
点评:本题综合性强,难度较大,非常锻炼学生的思维能力。
本题难度:困难