1、填空题 如下图是一个乙醇燃料电池工作示意图,乙池中的两个电极一个是石墨电极,一个是铁电极,工作时M、N两个电极的质量都不减少,请回答下列问题:
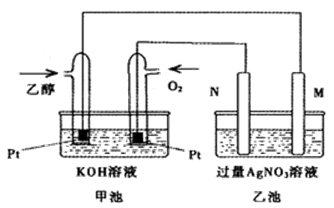
(1)M电极材料是 , N的电极反应式为 ,加入乙醇的铂电极的电极反应式为 。
(2)若在常温常压下,1g C2H5OH燃烧生成CO2和液态H2O时放出约为30kJ热量,表示乙醇燃烧热的热化学方程式为 。
(3)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液一段时间后,在两极上均生成11.2L(标准状况)气体。则M极产生的气体是H2,原混合液中Cu2+的物质的量浓度是 mol/L。
参考答案:(共8分)
(1)铁 (1分) 4OH—-4e—=2H2O+O2↑ (1分)C2H5OH-12e+16OH—=2CO32—+11H2O (2分)
(2)C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1380kJ/mol (2分)
(3)1 mol/L (2分)
本题解析:(1)甲池是燃料电池,乙池是电解池,通入氧气的一极是正极,则N极是阳极,则M极是阴极,M、N两个电极的质量都不减少,则铁作阴极,所以M极的材料是铁;N极发生氧化反应,根据离子的放电顺序,则在N极放电的书写氢氧根离子,失去电子生成氧气,电极反应式为4OH—-4e—=2H2O+O2↑;加入乙醇的一极是原电池的负极,发生氧化反应,结合电解质溶液,生成碳酸根离子和水,电极反应式为C2H5OH-12e+16OH—=2CO32—+11H2O;
(2)1mol乙醇的质量是46g,所以1mol乙醇完全燃烧生成CO2和液态H2O时放出46×30kJ=1380kJ的热量,所以乙醇燃烧的热化学方程式为C2H5OH(l)+3O2(g)=2CO2(g)+3H2O(l) △H=-1380kJ/mol ;
(3)若M、N均为石墨电极,将乙池改为电解500mL含KNO3和Cu(NO3)2的混合液,当M极放出氢气时,说明铜离子放电完全,N极产生氧气,根据4OH—-4e—=2H2O+O2↑,可知生成标准状况下11.2L氧气,失去电子的物质的量是11.2L/22.4L/mol×4=2mol,生成11.2L氢气时得到电子的物质的量是11.2L/22.4L/mol×2=1mol,则铜离子共得到1mol电子,根据Cu2++2e-==Cu,可知铜离子的物质的量是1/2mol,所以原混合液中Cu2+的物质的量浓度是1/2mol/0.5L=1.0mol/L。
考点:考查电化学反应原理的应用,氧化还原反应的计算
本题难度:一般
2、填空题 (12分)(1)由氢气和氧气反应生成1 mol水蒸气放热241.8kJ,写出该反应的热化学方程式: 。若1g水蒸气转化成液态水放热2.5kJ,则氢气的燃烧热为△H= kJ/mol。
(2)近年来已经研制出甲烷(CH4)燃料电池,该电池的电解质溶液为H2SO4溶液,
写出该电池负极的电极反应式:_____________________________。
该电池总反应式:_____________________________。
(3)用惰性电极电解AgNO3溶液,写出该电解反应的化学方程式 ;若在阳极收集到 0.32 g O2,中和电解生成的酸需0.4 mol·L-1NaOH溶液 mL
参考答案:(1)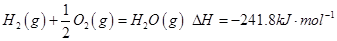 ;—286.8;
;—286.8;
(2)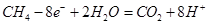 ;
; ;
;
(3)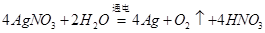 ;100
;100
本题解析:根据热化学方程式书写原则,该反应的热化学方程式为 ;18g水蒸气转化成液态水放热2.5kJ×18,由氢气和氧气反应生成1 mol液态水放热241.8kJ+2.5kJ×18,所以氢气的燃烧热为△H=—286.8kJ/mol;(2)甲烷燃料电池,电解质溶液为H2SO4溶液,总反应即甲烷燃烧的方程式
;18g水蒸气转化成液态水放热2.5kJ×18,由氢气和氧气反应生成1 mol液态水放热241.8kJ+2.5kJ×18,所以氢气的燃烧热为△H=—286.8kJ/mol;(2)甲烷燃料电池,电解质溶液为H2SO4溶液,总反应即甲烷燃烧的方程式 ,负极反应为甲烷失电子,发生氧化反应,反应式为
,负极反应为甲烷失电子,发生氧化反应,反应式为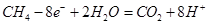 。(3)电解AgNO3溶液,阳极OH—发生氧化反应生成氧气,阴极Ag+的电子发生还原反应生成银单质,所以总反应为
。(3)电解AgNO3溶液,阳极OH—发生氧化反应生成氧气,阴极Ag+的电子发生还原反应生成银单质,所以总反应为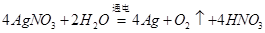 ;得到0.01mol gO2,生成硝酸0.04mol,所以消耗氢氧化钠0.04mol,根据
;得到0.01mol gO2,生成硝酸0.04mol,所以消耗氢氧化钠0.04mol,根据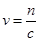 ,消耗氢氧化钠溶液100mL
,消耗氢氧化钠溶液100mL
考点:本题考查热化学方程式、燃料电池、电解原理。
本题难度:一般
3、选择题 图1是在金属锌板上贴上一张用某溶液浸湿的滤纸,图2是新型氢氧燃料电池,则下列说法中不正确的是( )
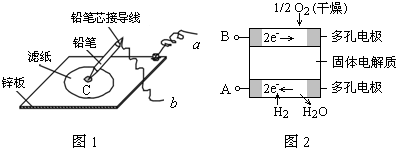
A.图2电池放电过程中,O2-从B极区向A极区迁移
B.图2电池负极区的电极反应为H2-2e-+O2-=H2O
C.若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则铅笔芯C点处出现红色
D.若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,铅笔芯C点处出现蓝色,则b接的是A电极
参考答案:A、图2是氢氧燃料电池,燃料电池放电过程中,阴离子O2-从正极区向负极区迁移,通燃料气体的A极是负极,通氧气的B极是正极,即O2-从B极区向A极区迁移,故A正确;
B、图2是氢氧燃料电池,燃料电池放电规律是:通燃料气体的A极为负极,燃料在该极失电子,通氧气的B极是正极,氧气在该极得电子,所以负极区的电极反应为H2-2e-+O2-=H2O,故B正确;
C、若用氯化钠和酚酞的混合溶液浸湿滤纸,用导线将a、b直接相连,则锌电极为负极,锌失电子,铅笔芯为正极,氧气得电子,在该极生成大量的氢氧化钠,能使酚酞变红色,故C正确;
D、若用KI淀粉溶液浸湿滤纸,用导线将a、b与A、B电极相连,A极是负极,B极是正极,阳极放电的是碘离子,碘单质遇到淀粉显蓝色,而铅笔芯C点处出现蓝色,所以C点放电的是碘离子,b为正极,b接的是B电极,故D错误.
故选D.
本题解析:
本题难度:简单
4、选择题 某学习小组为研究电化学原理,设计下图装置。下列叙述正确的是
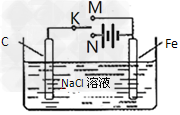
[? ]
A.K与M、N均断开时,铁不会发生反应
B.K与M相连时,?碳棒电极反应:2H++2e-=H2↑
C.K分别与M、N相连时,铁均受到保护
D.K与N相连时,?碳棒上产生使湿润的淀粉碘化钾试纸变蓝的气体
参考答案:D
本题解析:
本题难度:一般
5、选择题 在盛有稀H2SO4的烧杯中插入用导线连接的锌片和铜片,下列叙述正确的是
A.正极附近的SO4 2- 离子浓度逐渐增大
B.铜片上有H2逸出
C.溶液的pH逐渐变小
D.电子通过导线由铜片流向锌片
参考答案:B
本题解析:原电池中较活泼的金属是负极,失去电子,发生氧化反应。电子经导线传递到正极,所以溶液中的阳离子向正极移动,正极得到电子,发生还原反应。锌比铜活泼,则锌是负极,铜是正极,溶液中的氢离子在正极得到电子,所以选项B正确,其余选项都是错误的,答案选B。
点评:该题是高考中的常见题型和考点,属于基础性试题的考查。该题的关键是明确原电池的工作原理,然后结合题意和装置图灵活运用即可。
本题难度:一般