比较碳酸和醋酸电解质能力强弱
参考答案:D
本题解析:略
本题难度:一般
2、选择题 下列实验“操作和现象”与“结论”对应关系正确的是
?
| 操作和现象
| 结论
| A
| 处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解
| Ksp:CaCO3<CaSO4
| B
| 用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成
| 该电极为阳极
| C
| 向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出
| 氧化性:Cu2+>Fe3+
| D
| 向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成
| 该溶液中一定含有Ag+
|
?
参考答案:A
本题解析:A中由于碳酸钙的溶度积常数小于硫酸钙的溶度积常数,则根据沉淀容易向更难溶的方向转化可知,选项A正确;用石墨作电极电解MgSO4溶液,则阳极是溶液中的OH-放电,阳极附近水的电离平衡被破坏,溶液显酸性。阴极是溶液中的氢离子放电,则同样分析可知,阴极周围溶液显碱性,因此有氢氧化镁生成,选项B不正确;氧化性是Cu2+<Fe3+,选项C不正确;选项D中,溶液中也可能含有SO42-或SO32-,D不正确,答案选A。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,有利于培养学生规范严谨的实验设计、分析和评价能力。明确物质的性质及发生的化学反应是解答本题的关键,并熟悉氧化还原反应、离子的检验等来解答。
本题难度:简单
3、简答题 某课外活动小组做了如下关于钾的探究实验.
(1)钾与水反应
实验中钾常会着火燃烧,并发生轻微爆炸,由此现象可以得出的结论是______(任写一个),该反应的离子方程式是______.
(2)钾与氯气反应
该实验中可选用如下方案制备氯气,其中最合理的是______(填序号).
| 方案序号 | 所用试剂 | 净化剂 | 干燥剂
A
MnO2、稀盐酸
饱和食盐水
浓硫酸
B
Ca(ClO)2、浓盐酸
饱和食盐水
无水硫酸铜
C
氯酸钾、浓盐酸
饱和碳酸钠溶液
浓硫酸
D
KMnO4、浓盐酸
水
碱石灰
|
你所选取的最合理的方案中一定会用到的仪器是______(填序号).
A.长颈漏斗?B.圆底烧瓶
C.酒精灯?D.洗气瓶
(3)钾与氧气反应的实验
经查找资料知:钾与氧气反应可能生成K2O、K2O2、KO2.
①取一定量的钾在空气中点燃,使其充分反应;
②将生成物研成细粉备用;
③常温下,利用如图所示装置探究生成物成分及含量.
据此回答下列问题:
①使细粉末与水反应的操作是______.
②测量气体体积时应注意的事项是______.
③若钾与氧气燃烧的产物为K2O2、KO2,取燃烧产物3.94g进行上述实验,测得气体的体积为868.0mL,则KO2的质量分数约为______.
(已知:常温下,气体的摩尔体积为24.8L/mo1)
参考答案:(1)钾和水发生反应常会着火燃烧,并发生轻微爆炸,说明反应是放热反应,反应的离子方程式为:2K++2H2O=2K++2OH-+H2↑;
故答案为:钾与水反应放热,2K++2H2O=2K++2OH-+H2↑;
(2)A、MnO2、稀盐酸不能反应生成氯气,故A错误;
B、Ca(ClO)2具有强氧化性能氧化浓盐酸生成氯气,通过饱和食盐水除去氯化氢,通过无水硫酸铜吸收水蒸气,故B正确;
C、氯酸钾、浓盐酸反应生成氯气,通入饱和碳酸钠溶液吸收氯化氢反应生成二氧化碳,也吸收氯气反应,故C错误;
D、KMnO4具有强氧化性氧化浓盐酸生成氯气,水除去氯化氢,同时吸收氯气,碱石灰会吸收氯气,故D错误;
故选B.
制备氯气后的净化装置需要用洗气瓶进行,加入液体用分液漏斗,反应容器可以是试管、烧瓶等,反应有的需要加热反应,有的常温反应,故选D.
(3)①使细粉末与水反应的操作,将仪器A向左倾斜,使水与样品充分接触发生反应;
故答案为:将仪器A向左倾斜,使水与样品充分接触;
②依据实验装置,测量气体体积时应注意的事项是,将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
故答案为:将气体冷却到室温,移动量筒使量筒内外液面相平,使量筒内的气体压强与大气压相等,平视读数;
③设样品中K2O2为 xmol,KO2物质的量为ymol,依据化学方程式2K2O2+2H2O=4NaOH+O↑;4KO2+2H2O=4KOH+3O2↑;
得到110x+71y=3.94
x2+3y4=0.86824.8
解得:x=0.01,y=0.04,
所以KO2的质量分数=0.04×713.94×100%=72.08%
故答案为:72.08%
本题解析:
本题难度:一般
4、实验题 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原性铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
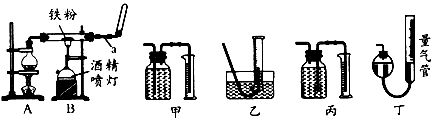
(1)仪器a的名称是________;烧瓶中所放的固体是____________。
(2)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成的气体的体积,计算铁粉的转化率。
①该同学应该先点燃____(填“A”或“B”,下同)处的酒精灯(或酒精喷灯),一段时间后,再点燃
____ 处的酒精灯(或酒精喷灯);测量气体体积不可以选用上图中的____(填“甲”“乙…"丙”或“丁”)装置;
②称取1.0g 铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为44.8
mL,则铁粉的转化率为________。
(3)为了分析反应后的固体混合物中是否含有+3价的Fe,该同学将反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色。请你在下表中将该同学滴加KSCN溶液后观察到的现象补充完整,并写出相应的结论与解释。

参考答案:(1)球形干燥管或干燥管碎瓷片;沸石或碎玻璃片
(2)①A;B;甲;② 8.4%
(3)不变;能;①Fe3O4 +8H+ = Fe2+ +2Fe3+ +4H2O;②Fe + 2Fe3+ = 3Fe2+
本题解析:
本题难度:一般
5、实验题 CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)某同学配制CuSO4溶液时,向盛有一定量CuSO4晶体的烧杯中加入适量蒸馏水,并不断搅拌,结果得到悬浊液。 他认为是固体没有完全溶解,于是对悬浊液加热,结果发现浑浊更明显了,原因是___, 最后,他向烧杯中加入了一定量的___溶液,得到了澄清溶液。
(2)该同学利用制得的CuSO4溶液,进行以下实验探究。

①图一是根据反应Zn+CuSO4==Cu+ZnSO4设计成的锌铜原电池。电解质溶液甲是___(填“ZnSO4”或 “CuSO4”)溶液;Cu极的电极反应式是___。
②图二中,I是甲烷燃料电池(电解质溶液为KOH溶液)的示意图,该同学想在Ⅱ中实现铁上镀铜,则b处通入的是___(填“CH4”或“O2”),a处电极上发生的电极反应式是___。
(3)将胆矾(CuSO4·5H2O)、生石灰和水按一定比例混合,即可得到波尔多液(杀菌剂),其有效成分为难溶的碱式硫酸铜[xCuSO4·yCu(OH)2]。为测定某碱式硫酸铜的组成进行了如下实验:取等质量的碱式硫酸铜样品两份,一 份滴加稀盐酸至恰好完全溶解,另一份高温灼烧后只得到CuO固体。所得数据显示n(HCl):n(CuO) =3:2,则该碱式硫酸铜的化学式中x:y=____。
参考答案:(1) Cu2+ +2H2O Cu(OH)2 +2H+,加热促进了Cu2+水解,生成了更多的难溶物Cu(OH)2; H2SO4 Cu(OH)2 +2H+,加热促进了Cu2+水解,生成了更多的难溶物Cu(OH)2; H2SO4
(2)①ZnSO4;Cu2+ +2e-==Cu;②O2;CH4-8e-+10OH-==CO32- +7H2O
(3)1:3
本题解析:
本题难度:一般
|