1、实验题 如图是铁与水蒸气反应的实验装置。在硬质玻璃管中放入还原性铁粉和石棉绒(石棉绒是耐高温材料,与水、铁不反应)的混合物,加热,并通入水蒸气,就可以完成高温下铁与水蒸气反应的实验。
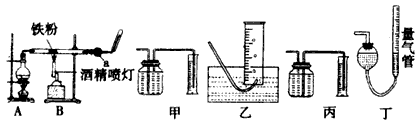
(1)仪器a的名称是________;烧瓶中所放的固体是____________
(2)某同学为了研究一定时间内铁粉的转化率,设计了如下实验:准确称量一定质量的铁粉进行反应,测量反应后生成气体的体积,计算铁粉的转化率。
①该同学应该先点燃____(填“A”或“B”,下 同)处的酒精灯(或酒精喷灯),一段时间后,再点燃
____处的酒精灯(或酒精喷灯);测量气体体积不可以选用上图中的______(填“甲”、“乙”、“丙”或“丁”)装置;
②称取1.0 g铁粉与适量石棉绒混合,然后加热反应一段时间。若测出的气体体积在标准状况下为
44.8 mL,则铁粉的转化率为____。
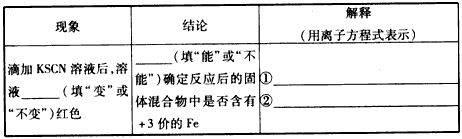
(3)为了分析反应后的固体混合物中是否含有+3价的Fe,该同学将反应后的固体混合物全部取出置于烧杯中,加入足量的盐酸,溶解后过滤,立即向滤液中滴加KSCN溶液,观察溶液的颜色。请你在下表中将该同学滴加KSCN溶液后观察到的现象补充完整,并写出相应的结论与解释。
2、简答题 硫酸铵是一种常用的铵态氮肥.下表是硫酸铵化肥品质的主要指标.?
指标
项目 | 优等品 | 一等品 | 合格品
外观
白色结晶,无可见机械杂质 | 无可见机械杂质
氮(N)含量
≥21.0%
≥21.0%
≥20.5%
|
某化学研究性学习小组为本地农业生产服务,对某农用品商店出售的一等品硫酸铵化肥的品质进行探究
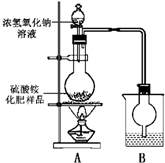
.?
[观察外观]
?该硫酸铵化肥无可见机械杂质.?
[实验探究]
?按如图所示装置进行实验.?
(1)烧瓶内发生反应的离子方程式为:______烧杯中盛放的试剂最好是______(填“浓硫酸”、“稀硫酸”或“水”)
(2)实验过程中,需往烧瓶中加入足量浓氢氧化钠溶液并充分加热的原因是______
[交流讨论]
甲同学:根据此实验测得的数据,计算硫酸铵化肥的含氮量可能偏高,因为实验装置中存在一个明显缺陷是:______
乙同学:实验装置中还存在另一个明显缺陷是:______
经过大家充分讨论一致认为:针对甲、乙两位同学指出的实验装置中存在的明显缺陷,需改进实验装置,重新进行实验
[探究结论]
称取13.5g硫酸铵化肥样品,用改进后的实验装置重新进行实验,测得实验后B装置增重3.4g.得出探究结论为______.
3、填空题 二氧化氯(ClO2)作为一种高效强氧化剂,已被联合国世界卫生组织(WHO)列为AI级安全消毒剂.常温下二氧化氯为黄绿色或橘黄色气体,性质非常不稳定.温度过高,二氧化氯的水溶液有可能爆炸.某研究小组设计如图所示实验制备ClO2.
(1)如图,在烧瓶中先放入一定量的KClO3和草酸(H2C2O4),然后再加入足量的稀硫酸,水浴加热.反应后产物中有ClO2、CO2和一种酸式盐,该反应的化学方程式为:______,
氧化产物与还原产物的物质的量之比为______.
(2)控制水浴温度在60~80℃之间的目的是______,
图示装置中缺少的一种必须的玻璃仪器是______.
(3)A装置用于吸收产生的二氧化氯,其中最好盛放______.(填序号)
①60℃的温水?②冰水?③饱和食盐水
(4)将二氧化氯溶液加入到硫化氢溶液中,所得溶液中加入少量氯化钡溶液,有白色沉淀生成.请写出二氧化氯溶液和硫化氢溶液反应的化学方程式______.
4、实验题 (1)某化学课外研究小组,设计实验探究KI溶液和FeCl3溶液反应存在一定的限度。请完成相关的实验步骤和现象。可选试剂:①0. 1mol·L-1KI溶液;②0. 1mol·L-1FeCl3溶液;③FeCl2溶液;④盐酸;⑤KSCN溶液;⑥CCl4。
实验步骤:
①取5mL 0. 1mol·L-1 KI溶液,再滴加5~6滴0. 1mol·L-1FeCl3溶液;
②充分反应后,将溶液分成三份;
③取其中一份,滴加试剂CCl4,用力振荡一段时间,CCl4层出现紫红色,说明反应生成碘。
④另取一份,滴加试剂____________,现象_______________,说明______________________。
(2)为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验。请回答相关问题:

①定性分析:如图甲可通过观察_______________________,定性比较得出结论。有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是_______________________。
②定量分析:如图乙所示,实验时均以生成40mL气体为准,其它可能影响实验的因素均已忽略。实验中需要测量的数据是______________________。
5、实验题 (9分)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:4NH4++6HCHO===3H++6H2O+(CH2)6N4H+[滴定时,1 mol(CH2)6N4H+与1 mol H+相当],然后用NaOH标准溶液滴定反应生成的酸.某兴趣小组用甲醛法进行了如下实验:
步骤Ⅰ:称取样品1.500 g.
步骤Ⅱ:将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀.
步骤Ⅲ:移取25.00 mL样品溶液于250 mL锥形瓶中,加入10 mL 20%的中性甲醛溶液,摇匀、静置5 min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点.按上述操作方法再重复2次.
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数________(填“偏高”、“偏低”或“无影响”).
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积________(填“偏大”、“偏小”或“无影响”).
③滴定时边滴边摇动锥形瓶,眼睛应观察______.
A.滴定管内液面的变化
B.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由______色变成_____________________色.
(2)滴定结果如下表所示:
滴定次数
| 待测溶液的体积/mL
| 标准溶液的体积
|
滴定前刻度/mL
| 滴定后刻度/mL
|
1
| 25.00
| 1.02
| 21.03
|
2
| 25.00
| 2.00
| 21.99
|
3
| 25.00
| 0.20
| 20.20
|
若NaOH标准溶液的浓度为0.101 0 mol/L,则该样品中氮的质量分数为________.