1、选择题 在一密闭容器中,反应mA(g)

nB(g)+nC(g)达到平衡后,保持温度不变,将容器体积压缩到原来的一半,当达到新的平衡时,B和C的浓度均是原来的1.8倍,则( )
A.平衡向正反应方向移动了
B.物质A的转化率增加了
C.物质C的质量分数增加了
D.m<2n
参考答案:假设m=2n,则保持温度不变,将容器体积压缩到原来的一半,平衡不移动,B和C的浓度应均是原来的2倍,但当达到新的平衡时,B和C的浓度均是原来的1.8倍,说明增大压强平衡向逆反应方向移动,则说明m<2n,
A、由以上分析可知,平衡应向逆反应方向移动,故A错误;
B、平衡向逆反应方向移动,A的转化率减小,故B错误;
C、、平衡向逆反应方向移动,物质C的质量分数减小,故C错误;
D、增大压强平衡向逆反应方向移动,则说明m<2n,故D正确.
故选D.
本题解析:
本题难度:简单
2、计算题 加热N2O5按下式分解:N2O5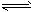 N2O3+O2,同时N2O3又按下式分解:N2O3
N2O3+O2,同时N2O3又按下式分解:N2O3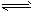 N2O+O2,在1L密闭容器中,将4mol N2O5加热并完全气化,到一定温度时建立平衡,此时容器中N2O5的浓度为1.62mol/L,O2的浓度为4.5mol/L,求该温度时,N2O5的分解率和N2O的平衡浓度。
N2O+O2,在1L密闭容器中,将4mol N2O5加热并完全气化,到一定温度时建立平衡,此时容器中N2O5的浓度为1.62mol/L,O2的浓度为4.5mol/L,求该温度时,N2O5的分解率和N2O的平衡浓度。
参考答案:解:设反应了的N2O5的浓度为x,生成的N2O的浓度为y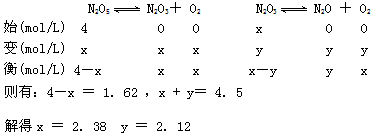 ?
?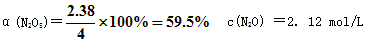
本题解析:
本题难度:一般
3、选择题 将1mol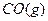 和1mol
和1mol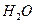 充入某固定容积的反应器中,在一定条件下,
充入某固定容积的反应器中,在一定条件下,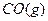 +
+
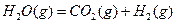 达到一定反应限度时有2/3的
达到一定反应限度时有2/3的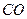 转化成
转化成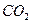 ,在相同条件下,将1mol
,在相同条件下,将1mol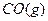 和2mol
和2mol 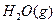 充入同一反应器中,当反应达到同一反应限度混合气体
充入同一反应器中,当反应达到同一反应限度混合气体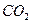 的体积分数可能是
的体积分数可能是
A.22.2%
B.28.2%
C.33.3%
D.37.8%
参考答案:B
本题解析:本题考查化学平衡计算;根据三段式:将1molCO和1molH2O充分反应达到平衡时:
CO? + H2O ="?" CO2 +? H2
开始:1mol? 1mol? 0? 0
转化:?
平衡:?
平衡时CO2的体积分数为:×100%=33.3%
若充入1molCO和2molH2O充分反应达到平衡时,假设有的CO转化为CO2:
CO? + H2O ="?" CO2 +? H2
开始:1mol? 2mol? 0? 0
转化:?
平衡:?
平衡时CO2的体积分数为:×100%=22.2%
由于反应中充入的H2的量增加,故CO的转化率增大,因此CO2的体积分数大于22.2%,而小于33.3%,B项符合题意。
本题难度:简单
4、选择题 某温度时,在2L容器中X、Y、Z三种物质的物质的量随时间的变化曲线如下图所示。由图像中数据分析,该反应的化学方程式和反应开始至2?min末Z的平均速率分别为

[? ]
A.X+Y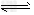 2Z;0.05?mol
2Z;0.05?mol L-1
L-1 min-1
min-1
B.X+Y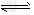 2Z;0.1?mol
2Z;0.1?mol L-1
L-1 min-1
min-1
C.X+2Y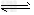 Z;0.1?mol
Z;0.1?mol L-1
L-1 min-1
min-1
D.X+3Y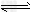 2Z;0.05?mol
2Z;0.05?mol L-1
L-1 min-1
min-1
参考答案:D
本题解析:
本题难度:简单
5、选择题 在一定温度下的定容密闭容器中,下列情况表明反应A(s)+2B(g)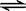 C(g)+D(g) 已达到反应限度的是
C(g)+D(g) 已达到反应限度的是
A.混合气体的密度保持不变
B.有1mol C生成的同时有1mol D生成
C.混合气体的总物质的量保持不变
D.有1 mol A生成的同时有1mol C消耗
参考答案:A
本题解析:略
本题难度:简单