1、填空题 锌和铝都是活泼金属,其氢氧化物既能溶于强酸,又能溶于强碱.但氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成[Zn(NH3)4]2+. 回答下列问题:
(1)单质铝溶于氢氧化钠溶液后,溶液中铝元素的存在形式为________(用化学式表示).
(2)写锌与强碱反应的化学方程式:______________________________________.
(3)下列各组中的两种溶液,用相互滴加的实验方法即可鉴别的是________.
①硫酸铝和氢氧化钠 ②硫酸铝和氨水 ③硫酸锌和氢氧化钠 ④硫酸锌和氨水
(4)写出可溶性铝盐与氨水反应的离子方程式:____________________.试解释在实验室不适宜用可溶性锌盐与氨水反应制备氢氧化锌的原因:_________________________.
参考答案:(1)AlO2-
(2)Zn+2NaOH===Na2ZnO2+H2↑
(3)①③④
(4)Al3++3NH3·H2O==Al(OH)3↓+3NH4+;可溶性锌盐与氨水反应产生的Zn(OH)2可溶于过量氨水中生成[Zn(NH3)4]2+,氨水的用量不易控制
本题解析:
本题难度:一般
2、实验题 如图1所示,某兴趣小组同学将铜片加入稀硝酸,发现开始时气泡产生速率非常慢,一段时间后速率明显加快,烧瓶内溶液呈浅蓝色并不断加深,液面上方的气体颜色也在不断加深。该小组同学拟通过实验探究反应速率变化的原因。
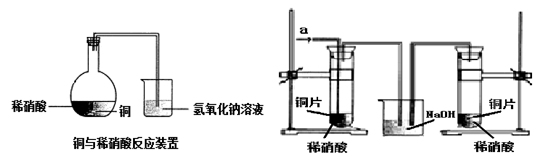
图 1?图 2
(1)图1中铜与稀硝酸反应的离子方程式为?;
用离子方程式表示NaOH溶液所起的作用?;
(2)小组同学提出了如下假设并设计实验探究:
Ⅰ.甲同学认为是反应放热导致溶液温度升高所致,完成此实验还需要的仪器是?;
测定反应过程中溶液不同时间的温度,结果如下表:
时间/min
| 0
| 5
| 10
| 15
| 20
| 25
| 35
| 50
| 60
| 70
| 80
|
温度/℃
| 25
| 26
| 26
| 26
| 26
| 26
| 26.5
| 27
| 27
| 27
| 27
|
?
结合实验目的和表中数据,你得出的结论是?;
Ⅱ.乙同学认为生成的Cu2+对反应有催化作用,为验证此假设,取A、B两支试管分别加入等量的铜片和稀硝酸,那么最好是在其中一支试管中加入少量的?(填序号)。
A.硝酸铜晶体? B.硝酸铜溶液? C.硫酸铜晶体? D.硫酸铜溶液
然后对比两支试管的反应,发现现象基本相同。因此得出结论:Cu2+并不是反应的催化剂。
Ⅲ. 丙同学根据现象推测反应过程中还有少量?生成,进而认为该物质对反应有催化作用,如图2所示,实验中丙同学从a处通入该物质后,发现左管中产生气泡速率明显快于右管。小组同学得出最后结论:这种物质对铜和稀硝酸的反应有催化作用。
(3)实验结束后,发现试管中溶液呈绿色,而不显蓝色。部分同学认为是该溶液中硝酸铜的质量分数较高所致,另一部分同学认为是该溶液中溶解了通入的物质。请你设计一个实验方案来证明哪种假设正确。(写出实验操作、实验现象和结论)?。
参考答案:(1)3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O (2分)
NO + NO2 + 2OH?=2NO2? + H2O(2分)
(2)Ⅰ.温度计 (2分)?温度不是速率明显加快的主要原因(2分)
Ⅱ.A(2分)?Ⅲ.NO2(2分)
(3) 加热该绿色溶液,观察颜色变化(或向该绿色溶液中通入氮气,观察颜色变化或向饱和硝酸铜溶液中通入浓硝酸与铜反应产生的气体,观察颜色变化)(2分)
本题解析:(1)硝酸具有强氧化性,稀硝酸的还原产物是NO,所以图1中铜与稀硝酸反应的离子方程式为3Cu + 8H+ + 2NO3?=3Cu2+ + 2NO↑ + 4H2O。反应中液面上方的气体颜色也在不断加深,这是由于NO被氧化生成了红棕色的NO2。不论是NO还是NO2都是大气污染物,需要尾气处理,所以氢氧化钠溶液的作用是吸收NO和NO2,防止污染空气,反应的离子方程式为NO + NO2 + 2OH?=2NO2? + H2O。
(2)I、如果是因为反应放热导致溶液温度升高所致,则必须测量溶液的温度,因此完成此实验还需要的仪器是温度计。根据表中数据可知,80min内溶液的温度只上升了2℃,这说明随着反应的进行,溶液的温度变化不明显,因此温度不是速率明显加快的主要原因。
Ⅱ、为验证铜离子是否有催化作用,作对比实验,在一支试管中加入含有铜离子的盐,一支试管中不加铜盐,然后比较反应速率,根据反应速率大小确定假设是否正确。为防止阴离子对实验的干扰,最好选择硝酸铜晶体,答案选A。
Ⅲ、根据液面上方的气体颜色也在不断加深可推断反应过程中还有少量NO2生成。
(3)如果试管中溶液呈绿色,而不显蓝色。是由于NO2引起的,则可以将将绿色的混合溶液加热,若能放出红棕色气体、且溶液变蓝色,说明这个假设正确或将NO2气体通入蓝色硝酸铜溶液中观察溶液颜色是否变绿色。
本题难度:一般
3、选择题 已知铜与稀硫酸不发生反应,但如果在铜与稀硫酸的混合溶液中加入某种盐,就能发生反应,且有气体、有沉淀产生,则该盐是
A.FeCl3
B.Ba(NO3)2
C.Na2SO4
D.KCl
参考答案:B
本题解析:A、铁离子的氧化性强于铜离子的,因此铁离子能把铜氧化生成铜离子,而铁离子被还原为亚铁离子,但无气体生成,A不正确;B、在酸性条件下NO3-具有强氧化性,能和铜发生氧化还原反应生成硝酸铜、NO和水,B正确;C、硫酸钠与单质铜不反应,C不正确;D、氯化钾与单质铜也不反应,D不正确,答案选B。
本题难度:一般
4、填空题 下图是氮元素的几种价态与物质类别的对应关系:
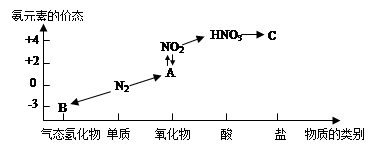
回答下列问题:
(1)写出N2的一种用途?。
(2)从N元素化合价分析,N2具有氧化性和还原性。各举一例说明(用化学方程式表示)
答:氧化性?。
还原性?。
(3)HNO3与上图中的物质C常用于检验Cl-的存在,则C的化学式为________。
(4)实验室制取物质B的化学方程式为?。
(5)NO2与水反应生成物质A的化学方程式为?。
(6)浓硝酸与木炭在加热条件下反应的化学方程式为?。
参考答案:(1)做保护气、保存粮食、制氨气等。
(2)N2+3H2 2NH3,?N2+O2
2NH3,?N2+O2 2NO或N2+3Mg
2NO或N2+3Mg Mg3N2等
Mg3N2等
(3)AgNO3
(4)Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(5)3NO2+H2O=2HNO3+NO
(6)4HNO3(浓)+C CO2↑+4NO2↑+2H2O
CO2↑+4NO2↑+2H2O
本题解析:(1)由于氮气化学性质不活泼,所以做保护气、保存粮食、制氨气等。(2)N2得到电子,化合价降低,表现氧化性:N2+3H2 2NH3;N2失去电子,化合价升高,表现还原性:N2+O2
2NH3;N2失去电子,化合价升高,表现还原性:N2+O2 2NO或N2+3Mg
2NO或N2+3Mg Mg3N2。(3)Cl-的检验方法是向待测溶液中加入硝酸酸化,再滴加AgNO3溶液,若产生不是沉淀,就证明溶液中含有Cl-。因此C为AgNO3。(4)在实验室中是用铵盐与碱共热来制取氨气的。制取物质氨气的化学方程式为Ca(OH)2+2NH4Cl
Mg3N2。(3)Cl-的检验方法是向待测溶液中加入硝酸酸化,再滴加AgNO3溶液,若产生不是沉淀,就证明溶液中含有Cl-。因此C为AgNO3。(4)在实验室中是用铵盐与碱共热来制取氨气的。制取物质氨气的化学方程式为Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O。(5)NO2与水反应生成物质NO的化学方程式为3NO2+H2O=2HNO3+NO。(6)浓硝酸有强氧化性,在加热条件下与木炭发生反应产生CO2、NO2、H2O。反应的化学方程式为4HNO3(浓)+C
CaCl2+2NH3↑+2H2O。(5)NO2与水反应生成物质NO的化学方程式为3NO2+H2O=2HNO3+NO。(6)浓硝酸有强氧化性,在加热条件下与木炭发生反应产生CO2、NO2、H2O。反应的化学方程式为4HNO3(浓)+C CO2↑+4NO2↑+2H2O。-的检验、及氮元素的单质及化合物的性质的化学方程式表示的知识。
CO2↑+4NO2↑+2H2O。-的检验、及氮元素的单质及化合物的性质的化学方程式表示的知识。
本题难度:一般
5、实验题 已知KNO3、Cu(NO3)2、AgNO3三种硝酸盐热分解的反应方程式如下(条件都是加热):
①2KNO3=2KNO2+O2↑
②2Cu(NO3)2=2CuO+4NO2↑+O2↑
③2AgNO3=2Ag+2NO2↑+O2↑
今有某固体可能由上述三种硝酸盐中的一种或几种组成。取适量该固体充分加热,得到一定量的气体,将这些气体通入水中,结果全部被吸收,没有剩余,回答:
(1)该固体是否可能只由一种盐组成?若可能,指出是哪种盐,若不可能,说明原因。___________________________________________________________________________________.
(2)若固体是混合物,指出它的可能组成(即物质的量之比),若没有这种组成,也请说明__________________________________________________________________________________。
参考答案:(1)可能,Cu(NO3)2分解所得NO2、O2物质的量之比为4:1,通入水中发生反应:4NO2+O2+2H2O=4HNO3,全部吸收。
(2)没有这种组成。由(1)可知,只有当NO2、O2物质的量之比为4:1时才可能被完全吸收,若为混合物,则不可能出现4:1的情况,因此不会有这种组成.
本题解析:附:另有一种题型---……若该气体经水充分吸收后,剩余气体的体积在同温同压下为吸收前的1/6,(后面问题相同)
---答:
(1)可能;AgNO3.
(2)KNO3和Cu(NO3)2物质的量之比为1:1;
或者由三种盐组成,其中KNO3和Cu(NO3)2物质的量之比为1:1,而AgNO3物质的量是任意的。
本题难度:简单