1、简答题 在实验室中配制500ml?0.2mol/L的碳酸钠溶液.
(1)用托盘天平称量需要碳酸钠的质量为2.1克.
(2)配制过程有以下5步操作:
①向盛有碳酸钠的烧杯中加入20ml水使其溶解;
②继续往容量瓶中加水至液面接近刻度线1~2cm;
③将碳酸钠溶液沿玻璃棒注入500ml容量瓶中;
④在烧杯中加入少量的水,小心洗涤2~3次,并将洗涤液移入容量瓶中;
⑤改用胶头滴管加水至刻度线,加盖摇匀.
正确的操作顺序为______.
(3)上述操作中,③中使用了玻璃棒,它的作用为______.
(4)以下操作会对所配制溶液浓度造成怎样的影响?(填“偏高”、“偏低”或“无影响”)
①容量瓶在用蒸馏水洗净后未干燥______.
②定容时俯视刻度线______.
参考答案:(2)配制一定物质的量浓的溶液的步骤:查漏、计算、称量、溶解、移液、定容、摇匀,故答案为:①③④②⑤;
(3)在移液操作中,为了防止液体外溅,要使用玻璃棒来引流,故答案为:引流;
(4)①容量瓶在用蒸馏水洗净后未干燥,不影响实验结果,因为容量瓶中就是要加入一定量的水的,故答案为:无影响;
②定容时俯视刻度线,这样导致实际加入水的量不到刻度线,即公式c=nV中的V减小,所以结果偏高,故答案为:偏高.
本题解析:
本题难度:一般
2、选择题 从1L?3mol/L的NaCl溶液中取出100mL溶液,则取出的溶液中含NaCl
A.3mol
B.0.3mol
C.0.1mol
D.175.5g
参考答案:B
本题解析:分析:根据溶液为均一、稳定的混合物,可知1L溶液的浓度和100ml溶液的浓度相等,根据n=cV计算NaCl的物质的量.
解答:1L溶液的浓度和100ml溶液的浓度相等,
则100mL溶液含NaCl的物质的量为:n=cV=0.1L×3mol/L=0.3mol,
故选B.
点评:本题考查物质的量浓度的计算,题目难度不大,注意溶液为均一、稳定的混合物,1L溶液的浓度和100ml溶液的浓度相等.
本题难度:简单
3、选择题 用NaOH固体,配制250mL0.5mol/LNaOH溶液,在下列仪器中选出正确的组合:
①托盘天平、②量筒、③烧杯、④玻璃棒、⑤漏斗、⑥500mL容量瓶、
⑦药匙、⑧250mL容量瓶、⑨胶头滴管、⑩坩埚
[? ]
A.①③④⑥⑨⑩
B.①④⑦⑧⑨⑩
C.①③④⑦⑧⑨
D.①②④⑤⑧⑨
参考答案:C
本题解析:
本题难度:简单
4、选择题 配制一定体积、一定物质的量浓度的溶液,下列操作会使配得的溶液浓度偏小的是( )
A.容量瓶中原有少量蒸馏水
B.定容时观察液面俯视
C.滴管加水时,有少量水滴到容量瓶外
D.溶液从烧杯转移到容量瓶中后没有洗涤烧杯
参考答案:D
本题解析:
本题难度:一般
5、填空题 (1)写出下图中序号①~③仪器的名称:
①______;②______;③______.
(2)仪器①~④中,使用时必须检查是否漏水的有______.(填仪器序号)
(3)如图是某学校实验室从化学试剂商店买回的浓硫酸试剂标签上的部分内容.现用该浓硫酸配制480mL1mol?L-1的稀硫酸.
可供选用的仪器有:
①胶头滴管②烧瓶③烧杯④玻璃棒⑤药匙⑥量筒⑦托盘天平. 请回答下列问题:
请回答下列问题:
a.该硫酸的物质的量浓度为______mol?L-1.
b.配制稀硫酸时,还缺少的仪器有______(写仪器名称).
c.经计算,配制480mL1mol?L-1的稀硫酸需要用量筒量取上述浓硫酸的体积为______mL.
d.对所配制的稀硫酸进行测定,发现其浓度大于1mol?L-1,配制过程中下列各项操作可能引起该误差的原因有______.
A.定容时,俯视容量瓶刻度线进行定容.
B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作.
C.转移溶液时,不慎有少量溶液洒到容量瓶外面.
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水.
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处.
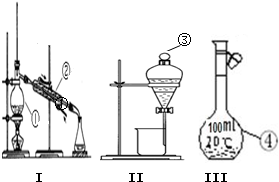
参考答案:(1)①根据①的构造可知,①为蒸馏操作中的主要仪器:蒸馏烧瓶,
故答案为:蒸馏烧瓶;
②仪器②为蒸馏操作中冷凝流出物的仪器:冷凝管,
故答案为:冷凝管;
③仪器③为分离互不相溶液体的仪器:分液漏斗,
故答案为:分液漏斗;
(2)①为蒸馏烧瓶、②为冷凝管、③为分液漏斗、④为容量瓶,其中①和②在使用前必须要检查是否漏水,而①分液漏斗有旋塞,使用前必须检查是否漏水,避免旋塞漏水,影响分离效果,③容量瓶在使用前也需要检查是否漏水,避免摇匀操作时漏液,
故答案为:③④;
(3)a.该浓硫酸的物质的量浓度为:1000×1.84×98%98mol/L=18.4mol/L,故答案为:18.4;
b.配制一定物质的量浓度的溶液步骤为:计算、量取、稀释、冷却、转移、洗涤、定容、摇匀等,需要选用的仪器为:量筒、烧杯、玻璃棒、容量瓶、胶头滴管、500mL容量瓶等,还缺少500mL容量瓶,
故答案为:500ml容量瓶;
c.配制480mL1mol?L-1的稀硫酸,实际上配制的是500mL 1mol/L的稀硫酸,配制500mL 1mol/L的稀硫酸,需要量取的浓硫酸的体积为:1mol/L×0.5L18.4mol/L≈0.0272L=27.2mL,
故答案为:27.2;
d.A.定容时,俯视容量瓶刻度线进行定容,会导致加入的蒸馏水体积偏小,配制的溶液浓度偏高,故A正确;
B.将稀释后的稀硫酸立即转入容量瓶后,紧接着就进行以后的实验操作,热的溶液体积偏大,冷却后溶液体积变小,配制的溶液浓度偏高,故B正确;
C.转移溶液时,不慎有少量溶液洒到容量瓶外面,导致配制的溶液中溶质的物质的量偏小,配制的溶液浓度偏低,故C错误;
D.容量瓶用蒸馏水洗涤后未干燥,含有少量蒸馏水,对溶质的物质的量和溶液体积没有影响,不影响配制结果,故D错误;
E.定容后,把容量瓶倒置摇匀后发现液面低于刻度线,便补充几滴水至刻度处,导致配制的溶液体积偏大,配制的溶液浓度偏低,故E错误;
故答案为:AB.
本题解析:
本题难度:一般