| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《反应速率与平衡的有关计算》高频考点预测(2017年最新版)(十)
参考答案:D 本题解析:A可能反应在c点之后才达到平衡。在平衡之前,正反应速率大于逆反应速率。错误。C c点时氨气与氢气的物质的量相等,但由于它们的浓度还发生变化,所以并未达到平衡。错误。C 在c点、d点由于外界条件没变,所以是同一条件下的平衡,氮气的物质的量相同。错误。D.题目给定温度是673K,若其他条件不变,773K下反应至t1时刻,温度升高,化学平衡向吸热方向移动即向逆反应方向移动。所以在平衡时氢气的含量要比673K高。正确。 本题难度:一般 3、填空题 (12分)在一定温度下的2 L密闭容器中充入0.4 mol SO2和0.2 mol O2 ,发生反应:2SO2(g)+O2(g) 参考答案:(1)0.025 mol/(L·min)(2分)? 20(2分)?减小(1分) 本题解析:(1)化学反应速率通常用单位时间内浓度的变化量来表示。0~4 min内氧气减少了0.1mol,则同时消耗二氧化硫是0.2mol,所以用SO2表示0~4 min内该反应的平均速率为 本题难度:简单 4、填空题 在一定条件下,在一容积可变的密闭容器中,将SO2和O2混合发生反应:
回答下列问题: (1)___________________________时段,反应处于平衡状态。 (2)第5min时,从同时提高速率和转化率两个方面分析,改变的外界条件是_____________;平衡向____________方向移动。(填“正”、“逆”或“不”) (3)其他条件相同、催化剂不同时,SO2的转化率随反应温度的变化如图a。,Fe2O3和NiO作催化剂均能使S02的转化率达到最高,不考虑价格因素,选择Fe2O3的 主要优点是_____________。 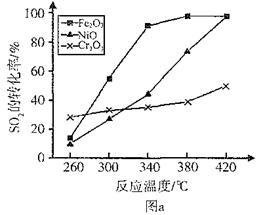 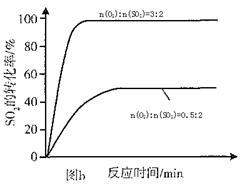 (4)科研小组在3800C Fe2O3作催化剂时,研究了不同投料比n(O2):n(SO2)对S02转化率的影响,结果如图b。请在答题卡坐标图中画出n(O2):n(SO2)=1:2时,SO2转化率的预期变化曲线。 参考答案:(1)3~4min(2分)? 7~9min(2分)(2)增大压强(2分);正(2分)? 本题解析:(1)由表格中的数据分析知,3~4min和7~9min时SO2、O2、SO3的物质的量保持不变,为化学平衡状态;(2)从表中数据分析,第5min时,SO2和O2的物质的量减小,SO3的物质的量增大,说明平衡向正向移动,该反应为放热反应,改变的条件可能为增大压强或降低温度,而降温反应速率变慢,从同时提高速率和转化率两个方面分析,改变的外界条件只能是增大压强;(3)由图像可知,当其他条件相同时,2600C以Cr2O3作催化剂,SO2的转化率最大,反应速率最快;对比分别以Fe2O3和NiO作催化剂的图像知,以Fe2O3作催化剂时,能在较低的温度下使SO2达到较高的转化率,因此选择Fe2O3;(4)分析图像b知,当SO2的物质的量相同时,O2的物质的量越大,达平衡的时间越短,反应速率越快,SO2的平衡转化率越大,以此可画出n(O2):n(SO2)=1:2时SO2转化率的预期变化曲线。 本题难度:一般 5、选择题 下列措施或事实能用勒沙特列原理解释的是(? ) 参考答案:D 本题解析:如果改变影响平衡的1个条件,平衡就向能够减弱这种改变的方向进行,这就是勒沙特列原理。合成氨是放热反应,升高温度,平衡向逆反应方向移动,A不正确。B中反应前后体积不变,改变压强平衡不移动,颜色加深是因为容积减小,浓度增大引起的,B不正确。C是电化学腐蚀,不是可逆反应,不正确。氯离子浓度越大,氯气溶解的就越少,所以正确的答案是D。 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点归纳《摩尔质量》.. | |