1、选择题 下列各物质中所含的少量杂质,用括号内的物质能除去,并且不引进其他杂质的是( )
A.二氧化碳中所含的氯化氢(NaOH溶液)
B.氢气中所含的硫化氢(硫酸铜溶液)
C.乙酸乙酯中所含的乙酸(乙醇)
D.氯化钠溶液中所含的氯化钡(硫酸)
参考答案:B。
本题解析:除杂质的原则是:不增、不减、简便、易得。A中HCl和CO2均与NaOH溶液反应;B中H2S + CuSO4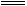 CuS↓+ H2SO4,而H2不反应,也不溶解;C中乙醇、乙酸、乙酸乙酯三者互溶;D中引入杂质(HCl、H2SO4)。
CuS↓+ H2SO4,而H2不反应,也不溶解;C中乙醇、乙酸、乙酸乙酯三者互溶;D中引入杂质(HCl、H2SO4)。
本题难度:简单
2、选择题 能使干燥的红色布条褪色的是( )
A.液氯
B.新制氯水
C.CaCl2溶液
D.盐酸
参考答案:氯气、液氯以及盐酸、CaCl2溶液中都不含有漂白性的HClO,而氯水中存在Cl2+H2O?H++Cl-+HClO,生成的HClO具有漂白性,可使干燥的红色布条褪色,
故选B.
本题解析:
本题难度:简单
3、计算题 实验室迅速制备少量氯气可利用如下所示的反应
2KMnO4?+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O ; 当参加反应的氧化剂的物质的量是1mol时,回答下列问题:
(1)被氧化的还原剂的物质的量是多少?
(2)产生标准状况下的氯气的体积多少升?
参考答案:(1)5mol?(2)56L
本题解析:略
本题难度:一般
4、填空题 (8分)二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂。比Cl2更好。
⑴在ClO2的制备方法中,有下列两种制备方法:
方法一:2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4=2ClO2↑+Na2SO4+O2↑ +2H2O
+2H2O
用方法二制备的ClO2更适合用于饮用水消毒,其主要原因是?。
⑵用ClO2处理过的饮用水(pH 5.5~6.5)常含有一定量对人体不利的亚氯酸根离子(ClO2-)。
饮用水中的ClO2、ClO2-含量可用连续碘量法进行测定。ClO2被I-还原为ClO2-、Cl-的转化率与溶液pH的关系如下图所示。当pH≤2 .0时,ClO2-也能被I-完全还原为Cl-。反应生成的I2用标准Na2S2O3溶液滴定;2Na2S2O3+ I2= Na2S4O6 + 2NaI
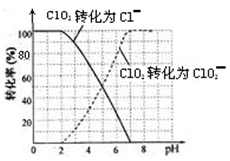
①请写出pH≤2 .0时ClO2--与I-反应的离子方程式?。
②请完成相应的实验 步骤:
步骤:
步骤1:准确量取V mL水样加入到锥形瓶中。
步骤2:调节水样的pH为7.0~8.0。
步骤3:加入足量的KI晶体。
步骤4:加入少量淀粉溶液,用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V1mL。
步骤5:?。
步骤6:再用c mol·L-1Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液V2?mL。
③根据上述分析数据,测得该饮用水中ClO2-的浓度为? ?mol·L-1(用含字母的代数式表示)。
?mol·L-1(用含字母的代数式表示)。
参考答案:(8分)⑴方法 二制备的ClO2中不含Cl2(2分)
二制备的ClO2中不含Cl2(2分)
⑵①ClO2-+4H++4I-=Cl-+2I2+2H2O(2分)
②调节溶液的pH≤2.0(2分)?③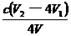 (2分)
(2分)
本题解析:略
本题难度:一般
5、选择题 丰富多彩的颜色变化增添了化学实验的魅力,下列有关反应颜色变化的叙述中,正确的是( )
①新制氯水久置后→浅黄绿色消失 ②淀粉溶液遇碘化钾→蓝色
③蔗糖中加入浓硫酸搅拌→白色④SO2通入品红溶液中→红色褪去
⑤氨气通入酚酞溶液中→红色.
A.①②④⑤
B.②③④⑤
C.①④⑤
D.①②③④⑤
参考答案:①氯水中存在Cl2+H2O?HCl+HClO,次氯酸易分解,则久置时次氯酸分解,平衡正向移动,氯水褪色,故正确;
②淀粉遇碘变蓝色,而不是碘离子,故错误;
③浓硫酸可使蔗糖脱水,蔗糖变黑,故错误;
④二氧化硫具有漂白性,可使品红褪色,故正确;
⑤氨气水溶液呈碱性,可使酚酞溶液变红,故正确.
故选C.
本题解析:
本题难度:一般