1、填空题 新制氯水中含有多种成分,分别做如下实验:
①将足量NaOH溶液滴入氯水中,产生氯水褪色现象,起作用的成分______
②将鲜花浸入氯水中会褪色,起作用的成分是______
③向淀粉碘化钾中加入氯水显蓝色,起作用的成分是______.
参考答案:溶液中存在反应:Cl2+H2O溶解
本题解析:
本题难度:简单
2、填空题 (8分)①—⑩分别代表有关反应物中的一种物质,请完成下列各题:
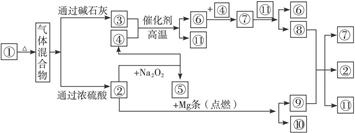
(1)①③④的化学式分别是__________________、___________________、_________________。
(2)⑧与⑨反应的化学方程式是
____________________________________________________。
参考答案:(1)NH4HCO3? NH3? O2
(2)C+4HNO3(浓)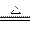 2H2O+4NO2↑+CO2↑
2H2O+4NO2↑+CO2↑
本题解析:由各物质之间转化关系可知,分解产生混合气体的应为不稳定的盐,由反应条件可知气体混合物为二氧化碳、氨气、水蒸气混合物。因此①为NH4HCO3或(NH4)2CO3,②为CO2,③为NH3,④为O2,⑤为Na2CO3,⑥为NO,⑦为NO2,⑧为HNO3,⑨为C,⑩为MgO,11为H2O。
本题难度:简单
3、填空题 氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为?。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为?。
(3)下列措施能增强84消毒液杀菌能力的是?。
A.加入适量醋酸? B.加入适量亚硫酸? C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是?。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为?。
参考答案:(7分)
(1)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (1分)
2NaOH + H2↑+ Cl2↑ (1分)
(2)Cl2 + 2OH-= Cl-+ ClO-+ H2O?(1分)
(3)A?(1分)
(4)B C(2分,少选得1分,多选、错选不得分)
(5)ClO-+2e-+ H2O→Cl-+2OH-(2分)
本题解析:
(1)工业生产通过电解饱和食盐水化学方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
(2)氯气与氢氧化钠溶液反应离子方程式:Cl2 + 2OH-= Cl-+ ClO-+ H2O?
(3)存在ClO-+ H2O HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
(4)A、溶液存在电荷守恒:c(Na+) + c(H+) = c(OH-) + c(Cl-)+ c(ClO-),错误;B、由电荷守恒,和溶液呈中性:c(H+) = c(OH-),知c(Na+) = c(ClO-) + c(Cl-),正确;C、根据氯发生歧化反应物料守恒知:c(ClO-) + c(HClO) =c(Cl-),结合c(Na+) = c(ClO-) + c(Cl-),得c(Na+) = 2c(ClO-) + c(HClO),正确。
(5)ClO-的强氧化性会氧化铁,所以正极反应为:ClO-+2e-+ H2O→Cl-+2OH-。
本题难度:一般
4、选择题 对于反应KMn04+ HCl—KC1+ MnCl2+Cl2+ H20(未配平),若有0.1 mol KMn04参加反应,下列说法正确的是?(?)?
A.转移0.5 mol电子
B.生成0.5 mol Cl2
C.参加反应的HC1为1.6 mol
D.Cl2是还原产物
参考答案:A
本题解析:略
本题难度:简单
5、选择题 将V(L) MgCl2溶液和V(L) NaCl溶液混合后,Cl-浓度为3 mol·L-1,则原MgCl2和NaCl两溶液物质的量浓度可能是
A.都是3 mol·L-1
B.分别是4 mol·L-1和1 mol-1
C.分别为1 mol·L-1和4 mol·L-1
D.都是6 mol·L-1
参考答案:C
本题解析:物质的量的浓度与体积无关,但混合时浓度与体积有关,等体积混合后,浓度为各组分浓度之和的一半.A.c(Cl-)=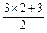 =4.5 mol·L-1不合.B项:
=4.5 mol·L-1不合.B项: =4.5 mol·L-1,不合.C.c(Cl-)=
=4.5 mol·L-1,不合.C.c(Cl-)=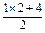 =3mol·L-1,合.D项:
=3mol·L-1,合.D项: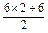 =9mol·L-1.
=9mol·L-1.
本题难度:一般