1、实验题 纯碱( Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
Na2CO3)在工业生产和生活中有重要应用,其实验室制法和工业制法如下:
【实验室制备纯碱】
(1)将饱和NaCl溶液倒入烧杯中加热,控制温度为30—35℃
(2)搅拌下分批加入研细的NH4HCO3固体,加料完毕,保温30分钟
(3)静置、过滤得NaHCO3晶体
(4)用少量蒸馏水洗涤、抽干
(5)将所得固体转入蒸发皿中灼烧得 Na2CO3固体
Na2CO3固体
问题:
①反应将温度需控制在30—35℃,通常采取的加热方法为?;控制该温度的原因是??;
②静置后只析出NaHCO3晶体的原因是?。
【工业制备纯碱】
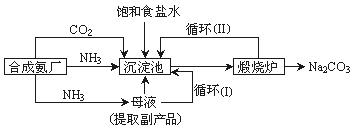
③沉淀池中反应的离子方程式为 ?;
④循环(I)、 循环(Ⅱ)中物质的化学式分别为 ?。
两种制备纯碱的方法中,共同涉及的化学反应方程式为?。
参考答案:①水浴加热(2分)
防止NH4HCO3分解而影响NaHCO3晶体的生成(2分)
②碳酸氢钠溶解度最小(2分)
③Na++NH3+H2O+CO2 = NaHCO3↓+NH4+(3分)
④NaCl、CO2(3分) ?2NaHCO3 ?Na2CO3+ CO2↑+ H2O?(3分)
?Na2CO3+ CO2↑+ H2O?(3分)
本题解析:略
本题难度:简单
2、填空题 (12分)硫酸被人们誉为“化学工业之母”,在国民生产中发挥着重要作用,硫酸的产量是衡量一个国家化学工业水平的标志。工业上生产硫酸包括三步:
(1)第一步,在沸腾炉中煅烧黄铁矿,反应如下:4FeS2+11O2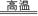 8SO2+2Fe2O3,该反应的氧化产物是?,当生成8 mol SO2时转移电子的物质的量为?。
8SO2+2Fe2O3,该反应的氧化产物是?,当生成8 mol SO2时转移电子的物质的量为?。
(2)第二步,在接触室中发生如下反应:2SO2+O2  ?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1?α2(填“大于”、“等于”或“小于”)。
?2SO3。某科技小组的同学在一个恒温恒容的容器中模拟该反应,他们分两次进行实验,第一次向容器中加入2 mol SO2、1 mol O2,反应达平衡后测得SO2的转化率为α1,第二次向容器中加入3 mol SO2、1.5 mol O2, 反应达平衡后测得SO2的转化率为α2,则α1?α2(填“大于”、“等于”或“小于”)。
(3)第三步,在吸收塔中将SO3转化成硫酸。硫酸是化学实验中的常用试剂:
①浓硫酸可以与多种物质发生化学反应,试写出浓硫酸与铜发生反应的化学方程式?。
②有Na、Mg、Al、Cu四种金属,若两两混合后取混合物14 g与足量稀硫酸反应,产生标准状况下H25.6 L,则此混和物的组合方式最多有?种。
参考答案:(1)Fe2O3、SO2 (2分)? 44mol (2分) (2)小于 (3分)?
(3)①Cu+2H2SO4(浓)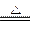 CuSO4+ SO2↑+2H2O (2分) ② 3? (3分)
CuSO4+ SO2↑+2H2O (2分) ② 3? (3分)
本题解析:略
本题难度:简单
3、选择题 下列化肥属于氮肥的是(? )
A.NH4Cl
B.KCl
C.(NH4)2SO4
D.K2SO4
参考答案:AC
本题解析:试题分析:氮肥就是以含有氮元素物质为主的肥料,所以答案为AC;BD为钾肥。
本题难度:一般
4、选择题 下列实验或实验改变,不符合化学实验“绿色化”的有( ? )
(1)在萃取溴水中溴单质的演示实验中,将萃取剂CCl4改为汽油
(2)在铜和浓硝酸反应制取NO2气体的实验中,将铜片改为铜粉
(3)将实验室制取CO2时产生的废液加入适量废碱液中和处理
A.只有(1)
B.只有(2)
C.只有(1)(2)
D.只有(3)
参考答案:C
本题解析:
本题难度:一般
5、选择题 没有采用循环操作的是(?)
A.硫酸工业
B.合成氨工业
C.硝酸工业
D.氯碱工业
参考答案:D
本题解析:硫酸工业中、合成氨工业中、硝酸工业中循环利用的分别是SO2、NO和NO2、N2及H2。
本题难度:简单