1、选择题 “绿色化学”提倡,设计制备物质的方案时,要从经济、环保和技术等方面考虑,以下由铜制取硝酸铜的四种方案中,比较符合“绿色化学”概念且可行的方案是( )
A.Cu→Cu(NO3)2
B.Cu→CuO→Cu(NO3)2
C.Cu→CuCl2→Cu(NO3)2
D.Cu→CuSO4→Cu(NO3)2
参考答案:B
本题解析:
本题难度:一般
2、填空题 合理、高效利用金属矿物,将其中的金属从其化合物中还原出来用于生产和制造各种金属材料,这一过程在工业上称为金属的冶炼。
(1)以HgO为原料冶炼Hg,冶炼方法是?。
(2)铝热法是冶炼金属的方法之一,写出铝热法炼铁(Fe2O3)的化学方程式:?。引发铝热反应的实验操作是:
?。
(3)某些金属氧化物粉末和铝粉在一定条件下可以发生铝热反应。下列反应速率(υ)和温度(T)的关系示意图中与铝热反应最接近的是:?(填字母)。
参考答案:(每空2分,共8分)(1)加热分解法
(2)Al+Fe2O3 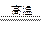 ?Al2O3 +2Fe。?加少量KClO3,插上Mg条并将其点燃。?
?Al2O3 +2Fe。?加少量KClO3,插上Mg条并将其点燃。?
(3)b
本题解析:略
本题难度:简单
3、选择题 下列说法中,不正确的是
A.现代科学技术的发展和环境问题的解决离不开化学科学
B.门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路
C.绿色化学最显著的特征是在生产化工产品过程中必须利用绿色植物为原料
D.植物的光合作用是地球上规模最大的化学反应,在生物体内把光能转变为化学能
参考答案:C
本题解析:现代科学技术的发展和环境问题的解决离不开化学科学,A正确;门捷列夫提出的元素周期律为发现新元素、合成新材料提供了新思路,B正确;“绿色化学”的核心是利用化学原理从源头上减少和消除工业生产对环境的污染;反应物的原子全部转化为期望的最终产物,而并不是必须利用绿色植物为原料,选项C不正确;植物的光合作用是地球上规模最大的化学反应,在生物体内把光能转变为化学能,D正确,答案选C。
点评:该题是常识性知识的考查,难度不大。注意相关知识的积累和总结即可,有利于培养学生的学习兴趣,调动学生的学习积极性。
本题难度:简单
4、填空题 (14分)镁及其化合物在生产生活中有重要的作用。以水氯镁石(主要成分为MgCl2·6H2O)为原料生产碱式碳酸镁的主要流程如下:

(1)上述流程中的滤液浓缩结晶,所得主要固体物质的化学式为?。指出该物质在工农业生产中的一种用途:?。
(2)写出预氨化时发生的主要反应的离子方程式:?。
(3)沉淀镁时反应的温度不宜过高,原因是?。
(4)设计一个实验,确定产品碱式碳酸镁aMgCO3·bMg(OH)2·cH2O中a、b、c的值,请完善下列实验步骤(可用试剂:浓硫酸、碱石灰):
①样品称量;②高温分解;③?;④?;⑤称量MgO。
18.2g产品完全分解后,产生6.6g CO2和8.0g MgO,由此可知,产品的化学式中:
a=?;b =?;c =?。
(5)从水氯镁石中可以提取无水氯化镁,电解熔融态的无水氯化镁可以得到金属镁。有同学认为:电解熔融的MgO也可制金属镁,在实际生产中可简化生产步骤,体现生产的简约性和经济性原则。你同意该同学的想法吗?为什么?你的观点是?。理由是?。
参考答案:(1)NH4Cl(1分)?做氮肥(或其他合理答案)(1分)
(2)Mg2++2NH3·H2O=Mg(OH)2↓+2NH4+(2分)
(3)防止碳酸氢铵分解(2分)
(4)③测出CO2的质量(1分)?④测出水蒸气的质量(1分)? 3;1;3(3分)
(5)不同意,因为MgO熔点很高,熔融时耗费大量的能量而增加生产成本(3分)
本题解析:略
本题难度:一般
5、填空题 (13分)以钛铁矿(主要成分FeTiO3,钛酸亚铁)为主要原料冶炼金属钛,生产的工艺流程图如下,其中钛铁矿与浓硫酸发生反应的化学方程式为:
FeTiO3+2H2SO4===TiOSO4+FeSO4+2H来源:91 考试网2O
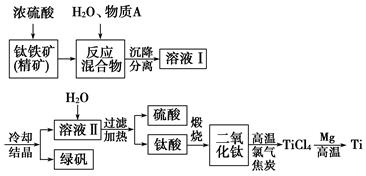
回答下列问题:
(1)钛铁矿和浓硫酸反应属于________(选填“氧化还原反应”或“非氧化还原反应”)。
(2)上述生产流程中加入物质A的目的是防止Fe2+被氧化,物质A是________,上述制备TiO2的过程中,所得到的副产物和可回收利用的物质分别是
_________________________,?
(3)反应TiCl4+2Mg 2MgCl2+Ti在Ar气氛中进行的理由是__________________
2MgCl2+Ti在Ar气氛中进行的理由是__________________
________________________________________________________________________。
(4)由二氧化钛制取四氯化钛所涉及的反应有:
TiO2(s)+2Cl2(g)+2C(s)===TiCl4(g)+2CO(g) ΔH1=-72 kJ·mol-1
TiO2(s)+2Cl2(g)===TiCl4(g)+O2(g) ΔH2=38.8 kJ·mol-1
C(s)+CO2(g)===2CO(g) ΔH3=282.8 kJ·mol-1
反应C(s)+O2(g)===CO2(g)的ΔH=________。
参考答案:(1)非氧化还原反应
(2)Fe 绿矾、硫酸
(3)防止高温下Mg(Ti)与空气中的氧气(或CO2、N2)作用
(4)-393.6 kJ·mol-1
本题解析:(1)根据方程式可看出,反应前后元素的化合价均没有方式变化,所以是非氧化还原反应。
(2)为反止Fe2+被氧化,且又不能引入杂质,A只能是铁。根据转化关系图可得硫酸和绿矾,硫酸可以回收利用,绿矾属于副产物。
(3)镁属于活泼金属,在加热时易被空气氧化。
(4)考查盖斯定律的应用。前2个反应相减得到2C(s)+O2(g)==="2CO" (g)? ΔH=-110.8 kJ·mol-1。根据C(s)+CO2(g)===2CO(g) ΔH3=+282.8 kJ·mol-1即可得到C(s)+O2(g)===CO2(g)的ΔH=-393.6 kJ·mol-1
本题难度:简单