1、选择题 判断下列有关化学基本概念的依据正确的是
A.置换反应:是否有单质参加
B.纯净物与混合物:是否仅含有一种元素
C.溶液与胶体:本质区别是分散质粒子的直径大小
D.电解质与非电解质:物质本身是否具有导电性
参考答案:C
本题解析:一种单质与一种化合物反应生成另外一种单质和另外一种化合物的反应是置换反应,选项A不正确;由同一种元素可以形成不同的单质,所以选项B不正确;溶于水或熔融状态下能够电离出阴阳离子的化合物是电解质,选项D不正确,答案选C。
本题难度:一般
2、填空题 (10分)铁及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(主要成分为FeS2)是生产硫酸和冶炼钢铁的重要原料。高温下可发生反应:
3FeS2+8O2 6SO2+Fe3O4
6SO2+Fe3O4
该过程中若有1.5mol FeS2参加反应,则反应过程中转移_____mol电子。
(2)氯化铁溶液显酸性,原因是___________________(用适当的文字和离子方程式解释),用惰性电极电解氯化铁溶液之初,阳极电极反应式为:____________________________________。
(3)高铁电池是一种新型二次电池,电解液为碱溶液,其反应式为:

放电时电池的负极反应式为____________________;充电时电解液的pH________(填“增大”“减小”或“不变”之一)。
参考答案:(每空2分,共10分) (1)16 (2)FeCl3电离出的Fe3+在水溶液中发生水解,使溶液显酸性。Fe3++3H2O Fe(OH)3+3H+ 2Cl--2e-=Cl2↑ Zn-2e-+2OH-=Zn(OH)2 减小
Fe(OH)3+3H+ 2Cl--2e-=Cl2↑ Zn-2e-+2OH-=Zn(OH)2 减小
本题解析:(1)根据方程式可知氧化剂只有氧气,消耗3molFeS2,转移8mol×4=32mol,所以该过程中若有1.5mol FeS2参加反应,则反应过程中转移16mol电子。
(2)铁离子水解,溶液显酸性离子方程式为Fe3++3H2O Fe(OH)3+3H+。用惰性电极电解氯化铁溶液之初,阳极失去电子,则溶液中的氯离子放电,则电极反应式为2Cl--2e-=Cl2↑。
Fe(OH)3+3H+。用惰性电极电解氯化铁溶液之初,阳极失去电子,则溶液中的氯离子放电,则电极反应式为2Cl--2e-=Cl2↑。
(3)根据方程式可知放电时锌是还原剂,作负极,因此放电时电池的负极反应式为Zn-2e-+2OH-=Zn(OH)2;电时消耗氢氧化钾,则电解液的pH减小。
考点:考查氧化还原反应以及电化学原理的应用
本题难度:一般
3、选择题 下列反应不属于四种基本反应类型,但属于氧化还原反应的是(?)
A.Fe+CuSO4===FeSO4+Cu
B.AgNO3+NaCl===AgCl↓+NaNO3
C.Fe2O3+3CO 2Fe+3CO2
2Fe+3CO2
D.2KMnO4 K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
参考答案:C
本题解析:A是置换反应,也是氧化还原反应;B是复分解反应,不是氧化还原反应;C是氧化还原反应,但不属于基本反应类型;D是分解反应,属于氧化还原反应,答案选D。
点评:该题是基础性试题的考查,难度不大。该题的关键是学生要熟练记住常见化学反应类型的判断标准,然后灵活运用即可。
本题难度:一般
4、选择题 有关化学用语正确的是
A.四氯化碳的电子式: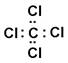
B.氢氧根的电子式:
C.乙烯的最简式 (实验式):C2H4
D.乙醇的结构简式:CH3CH2OH
参考答案:D
本题解析:
 正确答案:D
正确答案:D
A、氯原子电子没有写全;B、写的是羟基的电子式,氢氧根的电子式:
C、不正确,乙烯的最简式 (实验式)CH2;D、正确。
本题难度:一般
5、选择题 下列有关化学用语使用正确的是:
A.CH4分子的比例模型: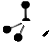
B.聚丙烯:
C.已烯的结构简式:CH2CH2
D.羟基的电子式: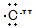
参考答案:D
本题解析:A错误,表示的是甲烷的球棍模型。
B错误,聚丙烯应存在支链。
C错误,双键不能省略。
D正确。
本题难度:简单