1、填空题 (14分)已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为________?__,该元素的符号是_________。
(2)Y元素原子的价电子的轨道表示式为__?__,该元素的名称是__________。
(3)X与Z可形成化合物XZ3,该化合物的空间构型为___?_________。
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_____________________________________。
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性高低________________________。(用分子式表示)
参考答案:(1)1s22s22p63s23p63d104s24p3(2分)? As(1分)
(2)?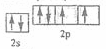 或
或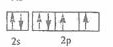 (2分)氧(1分)
(2分)氧(1分)
(3)三角锥形(1分)
(4)As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O(2分)
(5)稳定性:NH3 > PH3 > AsH3 ,( 2分)因为键长越短,键能越大,化合物稳定(2分)
本题解析:由题意可各X元素为As(砷)、Y元素为O元素、Z元素为H元素;所以
(1)?As元素原子基态时的电子排布式为1s22s22p63s23p63d104s24p3;
(2)?O元素原子的价电子的轨道表示式为 或
或 ;
;
(3)?X与Z可形成化合物XZ3为AsH3;空间构型为三角锥形;
(4)?X2Y3的化学式为As2O3;所以该反应的方程式为;As2O3 + 6Zn + 6H2SO4==2AsH3↑ + 6ZnSO4 + 3H2O
(5)?X的氢化物为AsH3,同族第二周期元素的氢化为NH3、第三周期氢化物为PH3,由于NH3分子间存在氢键,使其沸点高于同族的其他氢化物,所以,稳定性:NH3 > PH3 > AsH3 ;
本题难度:一般
2、选择题 .X、Y是元素中期表ⅦA族中的两种元素。下列叙述中能说明x的非金属性比Y强的是
A.X原子的电子层数比Y原子的电子层数多
B.Y的氢化物的沸点比X的氢化物的沸点高
C.X的气态氢化物比Y的气态氢化物稳定
D.Y的单质能将X从NaX的溶液中置换出来
参考答案:C
本题解析:非金属性强弱的比较可根据与氢化合的难易及气态氢化物稳定性、最高价含氧酸酸性强弱、单质间的置换反应等判断,所以选C。
本题难度:一般
3、选择题 若NA为阿伏加德罗常数,已知某元素的阴离子Rn-的原子核中,中子数为A-x+n,其中A为原子的质量数,则m g Rn-中电子总数为( )
A.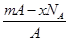
B.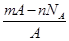
C.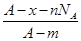
D.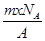
参考答案:D
本题解析:m g Rn-的总物质的量为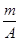 (mol),
(mol),
所含的电子总数为:[A-(A-x+n)+n]=x,
∴m gRn-的电子总数为: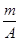 ·NA·x=
·NA·x=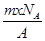 。
。
本题难度:一般
4、选择题 下列说法正确的是( )。
A.最外层有4个电子的原子都是非金属原子
B.非金属元素形成的单质只能与碱反应,不能与酸反应
C.金属氧化物不一定是碱性氧化物,碱性氧化物一定是金属氧化物
D.同主族金属的原子半径越大熔点越高
参考答案:C
本题解析:
考查元素周期表及周期律的知识。
A不正确,例如铅是金属;B不正确,例如碳能和硝酸反应;D不正确,例如第IA,所以答案选C。
本题难度:一般
5、填空题 甲元素的原子序数是19,乙元素原子核外有两个电子层,最外电子层上有6个电子;丙是元素周期表第ⅠA族中金属性最弱的碱金属元素。由此推断:
(1)甲元素在周期表中位于第________周期;乙元素在周期表中位于第________族;丙元素的名称为________。
(2)甲的单质与水反应的离子方程式为____________________________;
乙单质与丙单质反应的化学方程式为______________________________。
参考答案:(1)四 ⅥA 锂
(2)2K+2H2O=2K++2OH-+H2↑? 4Li+O2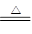 2Li2O
2Li2O
本题解析:甲的原子序数是19,甲是钾元素,乙是氧元素,丙是锂元素。
本题难度:一般