1、选择题 在周期表中第四周期的元素,原子核外未成对电子的最大数目为
A.4
B.5
C.6
D.7
参考答案:C
本题解析:略
本题难度:简单
2、选择题 下列有关比较,大小顺序排列错误的是
①热稳定性:PH3>H2S> HBr>NH3
②碱性:KOH>Ca(OH)2>Mg(OH)2>Al(OH)3
③物质的熔点:石英>食盐>汞>硫
④结合质子(H+)的能力:OH-> CO 32->CH3COO->SO42-
A.①②
B.①③
C.①④
D.③④
参考答案:B
本题解析:略
本题难度:简单
3、填空题 A、B、C、D、E是五种原子序数依次递增的短周期元素,已知:其中只有一种是金属元素;A和D元素的原子最外层电子数相同,C、E同主族,且E元素原子质子数是C元素原子质子数的2倍;B的最外层电子数是电子层数的两倍;C、A可形成两种常见的液态化合物甲和乙,且相对分子质量乙比甲大16。
(1)E元素的名称为:?;D的原子结构示意图为?。
(2)化合物乙中含有的化学键是?(填“极性共价键”或“非极性共价键”)。
(3)A单质与B、C形成的化合物可合成一种新型汽车动力燃料甲醇。
已知CO(g)+1/2O2(g)=CO2(g)
ΔH=-283 kJ/mol
H2(g)+1/2O2(g)===H2O(g)?ΔH=-242 kJ/mol
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)
ΔH=-651 kJ/mol
写出A与所选化合物合成甲醇的热化学方程式:?。
(4)EC2与C、D形成的化合物发生氧化还原反应的化学方程式为:?。
参考答案:(1)硫?
(2)极性共价键、非极性共价键
(3)CO(g)+2H2(g)=CH3OH(g)?ΔH=-116 kJ·mol-1
(4)Na2O2+SO2=Na2SO4
本题解析:短周期元素中同种主族元素的C、E两种元素,E的原子序数是C的2倍,E为S,C为O;B的最外层电子数是电子层数的两倍,且B的原子序数小于C,B为碳元素;A与O元素形成两种常见的液态化合物,A为H,D为Na,乙为H2O2,甲为H2O。
(1)Na的原子结构示意图为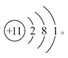
(2)H2O2中含有的化学键为极性共价键、非极性共价键。
(3)H2与CO反应制备CH3OH的热化学方程式,根据
CO(g)+1/2O2(g)=CO2(g)?ΔH=-283 kJ/mol?①?
H2(g)+1/2O2(g)=H2O(g)?ΔH=-242 kJ/mol?②
CH3OH(g)+3/2O2(g)=CO2(g)+2H2O(g)?ΔH=-651 kJ/mol ③可知,①+②×2-③即得该热化学方程式CO(g)+2H2(g)=CH3OH(g)?ΔH=-116 kJ·mol-1。
(4)SO2与Na2O2发生氧化还原反应生成Na2SO4,反应的化学方程式为Na2O2+SO2=Na2SO4。
本题难度:一般
4、选择题 下列关于铷(Rb)的叙述正确的是
A.它位于周期表的第四周期第ⅠA族
B.氢氧化铷是强碱
C.在钠、钾、铷3种单质中,铷的熔点最低
D.碳酸铷不溶于水
参考答案:BC
本题解析:略
本题难度:简单
5、选择题 已知X、Y均为1~18号之间的元素,X、Y可形成化合物X2Y和X2Y2,又知Y的原子序数小于X的原子序数,则两种元素的原子序数之和为( )。
A.19
B.18
C.27
D.9
参考答案:A
本题解析:可以形成X2Y和X2Y2化合物的元素可以是H和O或Na和O,Y的原子序数小于X的原子序数,所以只能是Na和O,则原子序数之和为19。
本题难度:一般