1、选择题 某元素原子的第4电子层有3个电子,则第3电子层的电子数有(?)个。
A.2
B.8
C.10
D.18
参考答案:D
本题解析:略
本题难度:简单
2、选择题 核内中子数为N的R2+离子,质量数为A,则n克它的氧化物所含电子物质的量为( )
A.
B.
C.
D.
参考答案:A
本题解析:核内中子数为N的R2+离子,质量数为A,则R的质子数=A-N。由于氧化物是RO,则n克它的氧化物所含电子物质的量为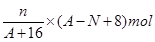 ,答案选A。
,答案选A。
点评:该题是高考中的常见题型,试题基础性强,重点考查学生对原子组成以及组成微粒之间数量关系的熟悉了解程度,有利于调动学生的学习兴趣,也有利于培养学生的逻辑推理能力和抽象思维能力。
本题难度:一般
3、填空题 (15分)六种短周期元素在周期表中的相对位置如下所示,其中E元素原子核外电子总数是其最外层电子数的3倍。关于元素周期表及这六种元素性质,请回答:
(1) 这六种元素的氢化物中,最稳定的是______(写化学式);
(2) AC2的结构式为________;
(3) 在一定条件下,由B单质与H2反应生成1 molG时,放出的热量为46.2 kJ,写出该反应的热化学方程式:______________________________
(4) 工业上用G检验输送氯气的管道是否漏气,可观察到大量白烟,同时有单质B生成,写出化学方程式____________________________________
该反应中被氧化的G与参与反应的G的质量之比________。
参考答案:H2O O=C=O? N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol? 8NH3+3Cl2===6NH4Cl+N2? 1∶4
2NH3(g) ΔH=-92.4 kJ/mol? 8NH3+3Cl2===6NH4Cl+N2? 1∶4
本题解析:(1)由E元素原子核外电子总数是其最外层电子数的3倍,可推知E为P,则A为C,B为N,C为O,D为Si,F为S,其中O的非金属性最强,其氢化物H2O最稳定。
(2)AC2为CO2结构式:O=C=O
(3)N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ/mol
2NH3(g) ΔH=-92.4 kJ/mol
(4)工业上用氨气检验输送氯气的管道是否漏气白烟为氯化铵:8NH3+3Cl2===6NH4Cl+N2,根据方程式8mol氨气反应有2mol被氧化,6mol未被氧化。
点评:熟练掌握元素周期表的相关知识。是解此类题目的关键。
本题难度:一般
4、选择题 几种短周期元素的原子半径及主要化合价如下表,相关说法正确的是
元素代号
| L
| M
| X
| R
| T
|
原子半径/nm
| 0.160
| 0.143
| 0.102
| 0.089
| 0.074
|
主要化合价
| +2
| +3
| +6、-2
| +2
| -2
|
A.离子半径大小:r(M3+) >r(T2-)? B.其中R的金属性最强
C.煤和石油中存在X元素? D.L、X形成的简单离子核外电子数相等
参考答案:C
本题解析:因元素的最高正价=最外层电子数=主族元素的族序数,最高正价和最低负价绝对值的和为8,同主族从上到下原子半径逐渐增大,X、T两元素最外层电子数为6,为第ⅥA元素,X的半径大于T,所以在周期表中T为O,X为S;L、R元素最外层电子数为2,为第ⅡA元素,且半径与L比R大,所以R为Be、L为Mg;M最外层电子数为3,为第ⅢA元素,且半径与L相差较小,同周期元素原子半径从左到右依次减小,所以M与L在同一周期,故M为Al,然后结合元素周期律和元素性质解答。
本题难度:一般
5、选择题 .下列说法正确的是
A.若发生A2+ 2D-=2A-+D2反应,则氧化性D2>A2
B.若X原子的质子数是a,中子数是b,则该核素可表示为baX
C.若相同温度和浓度的两种钠盐溶液的碱性NaA<NaB,则酸性HA>HB
D.若主族元素的简单离子R 2-和M+的电子层结构相同,则原子序数R>M
参考答案:C
本 题解析:选项A不正确,氧化剂的氧化性大于氧化产物的,氧化性应该是A2>D2;在表示原子组成时元素符号的左下角表示质子数,左上角表示质量,所以选项B中应该是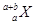 ,选项B不正确;酸越弱,相应的钠盐越容易水解,碱性就越强,所以选项C正确;选项D不正确,阴离子的原子序数小于阳离子的原子序数,答案选C。
,选项B不正确;酸越弱,相应的钠盐越容易水解,碱性就越强,所以选项C正确;选项D不正确,阴离子的原子序数小于阳离子的原子序数,答案选C。
本题难度:一般