1、填空题 (10分)如表所示为元素周期表的一部分,参照元素①~⑦在表中的位置,请回答下列问题:
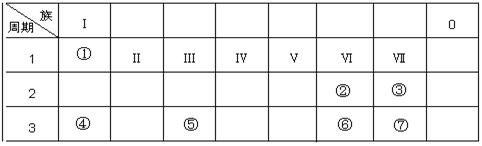
(1)③、④、⑦的原子半径由大到小的顺序为(用元素符号表示,下同) ;
(2)⑥和⑦的最高价含氧酸的酸性强弱为(用酸的化学式表示) ;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物,在酸性溶液中能将Fe2+氧化,写出该反应的离子方程式 ;
(4)由表中元素形成的物质可发生如图中的反应,其中B、C、G是单质,B为黄绿色气体,D溶液显碱性。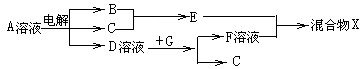
①写出D溶液与G反应的化学方程式: ;
②写出检验A溶液中溶质的阴离子的方法: ;
③常温下,若电解1L0.1mol/L的A溶液,一段时间后测得溶液pH为12(忽略溶液体积变化),则该电解过程中转移电子的物质的量为: ;
④若上图中各步反应均为恰好完全转化,则混合物X中含有的物质有: 。
参考答案:(1)(2分)Na>Cl>F (2)(2分)HClO4>H2SO4
(3)(2分)H2O2+2Fe2++2H+=2Fe3++2H2O (4)(4分,每小题1分)
① 2Al+2NaOH+2H2O=2NaAlO2+3H2↑
② 取少量A溶液滴加几滴稀硝酸酸化的硝酸银溶液有白色沉淀生成
③ 0.01 mol. ④ NaCl、Al(OH)3和H2O(水不写不扣分)
本题解析:根据元素在周期表中的位置,可知①为H、②为O、③为F、④为Na、⑤为Al、⑥为S、⑦为Cl,则
(1)同周期自左而右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,故原子半径:Na>Cl>F,故答案为:Na>Cl>F;
(2)非金属性Cl>S,非金属性越强,最高价含氧酸的酸性越强,故酸性:HClO4>H2SO4,故答案为:HClO4>H2SO4;
(3)①、②两种元素按原子个数之比为1:1组成的常见液态化合物为H2O2,在酸性溶液中能将Fe2+氧化Fe3+,同时生成水,反应离子方程式为:H2O2+2Fe2++2H+=2Fe3++2H2O,故答案为:H2O2+2Fe2++2H+=2Fe3++2H2O;
(4)由表中元素形成的物质,其中B、C、G是单质,B为黄绿色气体,则B为Cl2,D溶液显碱性,电解A溶液为电解氯化钠溶液生成氢气、氯气与氢氧化钠,故D为NaOH、C为H2,则E为HCl,G能与氢氧化钠溶液反应得到氢气与F,故G为Al,F为NaAlO2,则:
①D溶液与G反应的化学方程式为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑,故答案为:2Al+2N来源:91考试网 91ExaM.orgaOH+2H2O=2NaAlO2+3H2↑;
②检验NaCl溶液中溶质的阴离子的方法:取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成,故答案为:取少量A溶液滴加几滴(稀硝酸酸化)硝酸银溶液有白色沉淀生成;
③常温下,若电解1L 0.1mol/L的NaCl溶液,一段时间后测得溶液中的c(OH -)=10-2mol/L,则n(NaOH)=0.01mol/L×1L=0.01mol,由2NaCl+2H2O 2NaOH+H2↑+Cl2↑,可知成氯气为0.01mol×1/2=0.005mol,故转移电子物质的量=0.005mol×2=0.01mol,故答案为:0.01mol;
2NaOH+H2↑+Cl2↑,可知成氯气为0.01mol×1/2=0.005mol,故转移电子物质的量=0.005mol×2=0.01mol,故答案为:0.01mol;
④如图所示各步反应均为恰好完全转化,电解反应为2NaCl+2H2O 2NaOH+H2↑+Cl2↑,而2Al~2NaOH~2NaAlO2,得到偏铝酸钠与HCl物质的量之比为1:1,由H2O+HCl+NaAlO2
2NaOH+H2↑+Cl2↑,而2Al~2NaOH~2NaAlO2,得到偏铝酸钠与HCl物质的量之比为1:1,由H2O+HCl+NaAlO2
本题难度:困难
2、选择题 下图是电解CuCl2溶液的装置,其中c、d为石墨电极。则下列有关的判断正确的是

A.a为负极、b为正极
B.a为阳极、b为阴极
C.电解过程中,d电极质量增加
D.电解过程中,氯离子浓度不变
参考答案:C
本题解析:由于电流的方向是从电源的a电极到电解池的c,所以a是正极,b是负极。则c的阳极,d的阴极。在电解过程中由于阳离子的放电能力:Cu2+> H+,所以在阴极d电极上发生反应:Cu2++2e-=Cu, d电极质量增加;由于阴离子的放电能力:Cl->OH-,所以在阳极c上发生反应:2Cl-—2e-=Cl2↑.因此氯离子浓度会减小,在c电极上放出黄绿色的气体。因此正确的选项是C。
本题难度:一般
3、填空题 (20分)如图为相互串联的甲乙两个电解池,请回答:
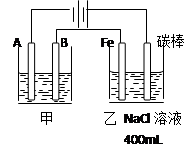
(1)若甲池为电解精炼粗铜(含有锌铁镍银金和铂等微量杂质,杂质发生的电极反应不必写出)装置,电解液选用CuSO4溶液,则:
①A电极发生的反应类型为?; B电极和Fe电极电子的流向由?到?(填B或Fe)。
②B电极的材料是____________,电极反应式为___________? _______。
CuSO4溶液的浓度?(填 “不变”“略有增加”或“略有减少”)
(2)实验开始时,若在乙池两边电极附近同时各滴入几滴酚酞试液,则:
①写出电解NaCl溶液总的化学方程式?
?。
②在Fe极附近观察到的现象是____? ________。检验碳棒电极反应产物的方法是 ?_。
(3)若甲槽电解液为CuSO4,实验中发现阴极增重12.8g,则乙槽阴极放出气体在标准状况下的体积为_____? ____L。若乙槽剩余液体为400mL,则电解后得到碱液的物质的量浓度为_______? ___?。
参考答案:(1) ①?还原反应? B到Fe(共2分)
②粗铜? Cu - 2e - = Cu2+?略有减少
(2) ①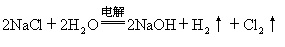 ,②溶液变红。把湿润的碘化钾淀粉试纸放在碳棒附近,试纸变蓝色。(3)4.48L? (4)1mol·L-1
,②溶液变红。把湿润的碘化钾淀粉试纸放在碳棒附近,试纸变蓝色。(3)4.48L? (4)1mol·L-1
本题解析:(1)根据装置图可看出,A是阴极、B是阳极、铁是阴极、碳棒是阳极。所以A电极发生还原反应,B发生氧化反应,电子由B电极通过导线传递到铁电极上。粗铜精炼时阳极必须连粗铜,电极反应式为Cu - 2e - = Cu2+。由于粗铜中含有比铜活泼的金属,当这些活泼的金属失电子时,在阴极上溶液的铜离子放电,所以CuSO4溶液的浓度略有减少。
(2)乙池是电解NaCl溶液的,阳极是碳棒,溶液中的氯离子放电,生成氯气,检验氯气可利用其氧化性通过湿润的碘化钾淀粉试纸来检验。铁是阴极,溶液中由水电离出来的氢离子生成氢气,所以在阴极周围溶液显碱性。
(3)阴极增重12.8g,说明析出铜是0.2mol,转移电子0.4mol。根据得失电子守恒可知乙槽阴极放出氢气是0.2mol,在标准状况下的体积为4.48L。根据电解的总方程式可知生成氢氧化钠是0.4mol,电解后得到碱液的物质的量浓度为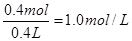
。
本题难度:一般
4、选择题 用惰性材料作电极,分别电解下列物质,当相同电量时,下列指定的电极上析出气体质量最大的是
A.熔融的NaCl(阳极)
B.NaCl溶液(阴极)
C.NaOH溶液(阴极)
D.Na2SO4(阳极)
参考答案:A
本题解析:电解熔融氯化钠、氯化钠溶液、氢氧化钠溶液和硫酸钠溶液的方程式分别为:2NaClO 2Na+Cl2↑~2e-、2NaCl+2H2O
2Na+Cl2↑~2e-、2NaCl+2H2O 2NaOH+Cl2↑+H2↑~2e-、2H2O
2NaOH+Cl2↑+H2↑~2e-、2H2O 2H2↑+O2↑~4e-、2H2O
2H2↑+O2↑~4e-、2H2O 2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。
2H2↑+O2↑~4e-,由电解方程式可知,每转移2mol电子,电解熔融氯化钠阳极得到1mol氯气,质量是71g、电解氯化钠溶液阴极得到1mol氢气,质量是2g、电解氢氧化钠溶液阴极产生1mol氢气,质量是2g,电解硫酸钠溶液阳极产生0.5mol氧气,质量是16g,所以电极上析出气体质量最大的是氯气,答案选A。
本题难度:一般
5、选择题 将两个铂电极插入500mLCuSO4溶液中进行电解,通电一段时间后,某一电极增重0.064g(设电解时该电极无氢气析出,且不考虑水解和溶液体积变化)。此时溶液中氢离子浓度约(? )
A.4×10-3mol·L-1
B.2×10-3mol·L-1
C.1×10-3mol·L-1
D.1×10-7mol·L-1
参考答案:A
本题解析:(1)电解质溶液中,阳离子在阴极获得的电子数等于阴离子在阳极所释放的电子数。(2)在阳极OH-的放电能力大于SO42-,其电极方程式为4OH--4e-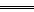 2H2O+O2↑,再据Cu2++2e-
2H2O+O2↑,再据Cu2++2e-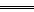 Cu及水的电离反应
Cu及水的电离反应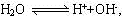 可得关系式“Cu~2H+”则
可得关系式“Cu~2H+”则
本题难度:一般