1、选择题 三氧化二镍(Ni2O3)可用于制造高能电池,其电解法制备过程如下:用NaOH调NiCl2溶液pH至7.5,加入适量硫酸钠后进行电解。电解过程中产生的Cl2在弱碱性条件下生成ClO-,把二价镍氧化为三价镍。以下说法正确的是
[? ]
A.可用铁作阳极材料
B.电解过程中阳极附近溶液的pH升高
C.阳极反应方程式为:2Cl--2e-=Cl2↑
D.1mol二价镍全部转化为三价镍时,外电路中通过了1mol电子
参考答案:CD
本题解析:
本题难度:一般
2、选择题 1L?1mol?L-1?AgNO3溶液在以Ag作阳极,Fe作阴极的电解槽中电解,当阴极增重2.16g时,下列判断中不正确的是( )
A.溶液的浓度仍为?1?mol?L-1
B.阳极上产生112?mL?(标准状况下)?O2
C.转移的电子数约为1.204×1022个
D.反应中有0.02?mol金属被氧化
参考答案:Ag作阳极,则阳极反应式为Ag-e-=Ag+,AgNO3溶液为电解质溶液,则阴极发生Ag++e-=Ag,
A.由上述分析可知,该过程为电镀,电解质溶液的浓度不变,故A正确;
B.阳极反应式为Ag-e-=Ag+,不会生成氧气,故B错误;
C.n(Ag)=2.16g108g/mol=0.02mol,则转移的电子数约为0.02×6.02×1023=1.204×1022个,故C正确;
D.由n(Ag)=0.02mol,阳极反应式为Ag-e-=Ag+,阴极发生Ag++e-=Ag,则反应中有0.02?mol金属被氧化,故D正确;
故选B.
本题解析:
本题难度:简单
3、选择题 高铁电池是一种新型可充电电池,与普通高能电池相比,该电池能长时间保持稳定的放电电压。高铁电池的总反应为3Zn + 2K2FeO4 + 8H2O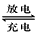 3Zn(OH)2 + 2Fe(OH)3 + 4KOH 下列叙述不正确的是
3Zn(OH)2 + 2Fe(OH)3 + 4KOH 下列叙述不正确的是
[? ]
A.放电时负极反应为:Zn-2e- +2OH-= Zn(OH)2
B.充电时阳极反应为:Fe(OH)3-3e- + 5OH- = FeO + 4H2O
C.放电时每转移3 mol 电子,正极有1mol K2FeO4被氧化
D.放电时正极附近溶液的碱性增强
参考答案:C
本题解析:
本题难度:一般
4、填空题 下图为细菌冶铜和火法冶铜的主要流程。
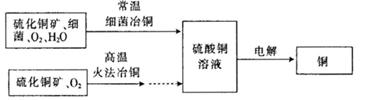
(1) 硫酸铜溶液一般呈________(填“酸”、“碱”或“中”)性,原因是________? (用离子方程式表示)。写出电解硫酸铜溶液的化学方程式:______________(电解过程中,始终无氢气产生)。
(2)细菌冶金又称微生物浸矿,是近代湿法冶金工业上的一种新工艺。细菌冶铜与火法冶铜相比,优点为________________(写出一点即可)。

(3) 用惰性电极分别电解浓的氯化铜溶液和硫酸铜溶液。电解浓的氯化铜溶液时发现阴极有金属铜生成,同时阴极附近会出现棕褐色溶液。而电解硫酸铜溶液时,没有棕褐色溶液生成。下面是关于棕褐色溶液成分的探究:
①有同学认为,阴极附近出现的棕褐色溶液是氯气反应的结果,你认为他的猜测是否正确?________(填“正确”或“不正确"),原因是__________
资料1:
一般具有混合价态(指化合物中同一元素存在两种不同的化合价,如Fe3O4中的 Fe元索)的物质的颜色比单一价态的物质的颜色要深。
资料2:
CuCl微溶于水,能溶于浓盐酸。
②猜想:棕褐色溶液中可能含有的离子是________(填3种主要离子符号)。
③验证猜想:完成实验方案(配制棕褐色溶液)。
取少量________固体于试管中,加入________使其溶解,再加入________溶液,观察现象。
④已知电解前,U形管中加入了________100mL0.5 mol . L-1 CuCl2溶液,电解结朿时电路中一共转移了 0.03 mol电子,且阴极生成0. 64 g铜,则形成的低价阳离子的物质的量为________mol。
参考答案:
(1)酸(1分);Cu2++2H2O Cu(OH)2+2H+(1分);2CuSO4+2H2O
Cu(OH)2+2H+(1分);2CuSO4+2H2O 2H2SO4+2Cu+O2↑(2分)
2H2SO4+2Cu+O2↑(2分)
(2)节约能源、环保、设备简单、操作方便.工艺条什易控制、投资少、成本低(或适宜处理贫矿、废矿、尾矿、炉渣等)(或其他合理答案)(2分)
(3)①不正确(1分);阴极不会产生氯气(2分)
②Cu2+、Cu+、Cl-、[CuCl2]-(只要写前三个即可)(2分)
③氯化亚铜;浓盐酸;氯化铜(所加|式剂顺序不对扣1分)(各1分)
④0.01(2分)
本题解析:该题分为两部分,前一部分是课本上知识内容的应用,比较简单,后一部分为对新现象的探究,有一定难度。探究题在解答的过程中要注意对新信息的收集和联系课本已有知识,进行整合。在电解过程中阳离子向阴极移动,阴离子向阳极移动,故在阴极上不可能生成氯气。根据新信息,多价态混合物质比单一物质颜色深,结合铜有+1、+2两个价态,可以进行相关猜测;然后根据CuCl的性质(溶于浓HCl)进行设计方案,探究。计算可以根据守恒法:生成0.01molCu,得到0.02mol电子,还有0.03=0.02=0.01mol电子为Cu2+得到电子生成Cu+,故生成Cu+为0.01mol。
本题难度:困难
5、选择题 将1L含有0.4molCuSO4和0.2molNaCl的水溶液用惰性电极电解,电解一段时间后,在一个电极上得到0.3molCu,另一个电极上产生气体(标况)的体积是
A.4.48L
B.5.6L
C.6.72L
D.13.44L