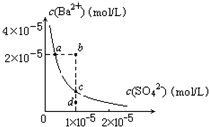
1、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如下图所示。下列说法正确的是( )

提示:BaSO4(s) Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
Ba2+(aq)+S(aq)的平衡常数Ksp=c(Ba2+)·c(S),称为溶度积常数。
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
参考答案:C
本题解析:A项加入Na2SO4会使Ba2+的浓度减小;B项,蒸发时,Ba2+与S的浓度变化是一致的;D项,温度不变,Ksp不变。
本题难度:一般
2、选择题 氢氧化镁固体在水中溶解,有下列平衡:Mg(OH)2(s)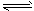 Mg2++ 2OH-,加入下列哪种固体物质可使
Mg2++ 2OH-,加入下列哪种固体物质可使
Mg(OH)2固体的质量减少
[? ]
A.Na2CO3
B.MgCl2
C.NH4Cl
D.NaCl
参考答案:C
本题解析:
本题难度:一般
3、简答题 室温时0.5L?2.0×10-4mol?L-1?BaCl2溶液中,滴入0.5L?1.0×10-3mol?L-1H2SO4溶液,能否析出沉淀?请计算混合后溶液的pH值.(已知Ksp(BaSO4)=1.1×10-10?mol2?L-2)
参考答案:c(Ba2+)=2.0×10-4/2=1.0×10-4mol?L-1,c(SO42-)=1.0×10-3/2=5.0×10-4mol?L-1.
Q=c(Ba2+)?c(SO42-)=5.0×10-8mol2?L-2>Ksp(BaSO4),所以会析出沉淀.
c(H+)=1.0×10-3×2/2=1.0×10-3,则pH=3.
答:析出沉淀;pH=3.
本题解析:
本题难度:一般
4、选择题 某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示.下列说法正确的是(提示BaSO4(s)?Ba2+(aq)+SO42-(aq)的平衡常数Ksp=[Ba2+]?[SO42-],称为溶度积常数)( )
A.加入Na2SO4可使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp