| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高中化学必备知识点《难溶电解质的溶解平衡》高频试题特训(2017年最新版)(六)
参考答案:C 本题解析:室温时,M(OH)2(s)?M2+(aq)+2OH-(aq),依据Ksp=c(M2+)c2(OH-)及Ksp=a,C(M2+)="b" mol?L-1,则c(OH-)=Ksp/ C(M2+)=a/bmol?L-1,所以c(H+)=" Kw/" c(OH?)=10?14/(a÷b)mol?L-1,则pH=-lgc(H+)=14+ 本题难度:一般 3、选择题 25℃时,在含有大量PbI2的饱和溶液中存在着平衡PbI2(s) A.溶液中Pb2+和I-浓度都增大 参考答案:CD 本题解析: 本题难度:一般 4、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下: 参考答案:A 本题解析: 本题难度:一般 5、简答题 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.
(1)在T1温度时,该反应的平衡常数K=
(2)在T2温度时,开始在100L的密闭容器中加入4.0molSO2和10.0molO2,一定条件下当反应达到平衡时共放出热量196kJ.此时二氧化硫的转化率为______. (3)在(2)中的反应达到平衡后,改变下列条件,能使SO2平衡浓度比原来减小的是______(填字母). A.保持温度和容器体积不变,充入1.0molO2 B.保持温度和容器内压强不变,充入2.0molSO2和5.0molO2 C.降低温度 D.在其他条件不变时,减小容器的容积 (4)有人设想以如图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式:______. (5)由硫酸可制得硫酸盐.在一定温度下,向K2SO4溶液中滴加Na2CO3溶液和BaCl2溶液,当两种沉淀共存时,
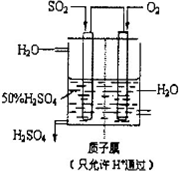 参考答案:(1)SO2+12O2?SO3△H=-98KJ?mol-1,向100L的恒容密闭容器中,充入3.0molSO2、16.0molO2和3.0molSO3, 本题解析: 本题难度:一般 |
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《电解池原理.. | |